БЕЛКИ́
-
Рубрика: Биология
-
-
Скопировать библиографическую ссылку:
БЕЛКИ́ (протеины), высокомолекулярные природные полимеры, построенные из остатков $\ce{L-α}$-аминокислот (см. Аминокислоты), соединённых амидной (пептидной) связью $\ce{–CO–NH–}$. Первый аминокислотный остаток полимерной цепи Б. называется $\ce{N}$-концевым, последний – $\ce{C}$-концевым. Каждый Б. характеризуется специфич. аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). Б. играют первостепенную роль в жизнедеятельности всех организмов. На их долю приходится не менее 50% сухой массы органич. соединений животной клетки и более 40% в клетках растений (самое высокое содержание Б. в семенах). Предполагается, что в природе существует неск. миллиардов разл. Б. Только в бактерии Escherichia coli насчитывают более 3000 Б. В составе генома человека идентифицировано ок. 29 тыс. кодирующих белки генов (пока у человека описано 1278 Б.). В живых организмах Б. образуются в ходе трансляции на рибосомах.
Исторический очерк
Название «Б.» впервые было дано веществу птичьих яиц, свёртывающемуся при нагревании в белую нерастворимую массу. Первые работы по выделению и изучению белковых веществ были выполнены в 18 в. Однако они носили описательный характер. В 19 в. Ж. Гей-Люссак и Л. Тенар первыми осуществили аналитич. исследования ряда Б. и установили, что белковые вещества сходны как по внешним признакам и свойствам, так и по элементному составу. Важным событием в изучении Б. явилось выделение из белкового гидролизата аминокислоты глицина (франц. химик А. Браконно, 1820). Первая концепция строения Б. (теория протеина) принадлежит голландскому химику Г. Мульдеру (1836). Он сформулировал понятие о минимальной структурной единице – протеине, присутствующей во всех Б., которой приписал следующий состав: $\ce{2C_8H_{12}N_2+5O}$. Позднее эта структура была уточнена ($\ce{C_{40}H_{62}N_{10}O_{12}}$), в состав некоторых Б. включены сера и фосфор.
Эта теория была повсеместно признана, но уже в 1846 Ю. Либих и работавший у него в лаборатории рос. химик Н. Лясковский высказали несогласие с определёнными её положениями, а спустя некоторое время она осталась в прошлом. Несмотря на это, труды Г. Мульдера привлекли большое внимание к аналитич. исследованиям Б., совершенствованию препаративных методов белковой химии, сделали Б. гл. объектом развивающейся химии природных соединений. Постепенно формируется представление о функциях Б. в живых организмах. В 1835 Й. Я. Берцелиус предположил, что Б. играют роль биокатализаторов. Вскоре были открыты протеолитические ферменты – пепсин (1836) и трипсин (1856). На формирование совр. представлений о структуре Б. повлияли работы нем. анатома и физиолога Г. Мейснера по расщеплению Б. протеолитическими ферментами. К кон. 19 в. было изучено большинство аминокислот, входящих в состав Б., и в 1894 А. Коссель выдвинул идею о том, что осн. структурными элементами Б. являются аминокислоты. В нач. 20 в. значит. вклад в изучение Б. внёс Э. Фишер, который, используя методы органич. химии, доказал, что Б. построены из $α$-аминокислот, связанных амидной связью. Он же сделал первые аминокислотные анализы Б., дал правильное объяснение протеолизу. В 1-й пол. 20 в. получили развитие физико-химич. методы анализа Б., определены молекулярные массы многих из них, получены данные о сферич. форме глобулярых Б. (Т. Сведберг, 1926). Был выделен белковый гормон – инсулин (Ф. Бантинг, Ч. Г. Бест, 1922), получены первые кристаллич. ферменты (Дж. Б. Самнер, 1926; Дж. Х. Нортроп, 1929), доказана белковая природа антител (1939), разработаны методы хроматографич. анализа Б. (А.Мартин, Р.Синг, 1944). В нач. 1950-х гг. была высказана идея о трёх уровнях организации белковых молекул (дат. биохимик К. У. Линдерстрём-Ланг, 1952), которая позднее нашла подтверждение. Развитие аналитич. методов привело к созданию автоматич. аминокислотного анализатора (С. Мур, У. Стайн, 1958), существенной модификации хроматографич. методов и совершенствованию рентгеноструктурного анализа; был создан секвенатор – прибор для определения последовательности аминокислотных остатков в Б. (П. Эдман, Дж. Бегг, 1967). В эти годы была определена структура нескольких сотен белков. Разработка эффективного метода анализа нуклеотидной последовательности ДНК (А. Максам и У. Гилберт, Ф. Сенгер) существенно облегчила определение последовательностей аминокислот в Б. исходя из данных о структуре кодирующих их генов. Это позволило устанавливать структуру Б., доступных в ничтожно малых количествах (напр., интерферон), а также Б., обладающих большой молекулярной массой (содержащих 700 и более аминокислотных остатков). Успехи структурного анализа позволили приступить к определению пространственной организации и молекулярных механизмов функционирования надмолекулярных комплексов, в т. ч. рибосом и вирусов. В кон. 20 в. появилась новая область исследования Б. – протеомика, в задачу которой входит комплексный анализ совокупности белков отд. клеток, органов и систем, функционирующих в данный конкретный момент времени в норме и при патологии.
Биологическое значение
Б. выполняют многочисл. функции. Обмен веществ (пищеварение, дыхание, выделение и др.) и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимич. реакций, являющихся Б. Защитные системы высших организмов формируются защитными Б., к которым относятся иммуноглобулины, Б. комплемента, цитокины иммунной системы, Б. системы свёртывания крови (в т. ч. плазмин, тромбин, фибрин). Важную группу составляют регуляторные Б., контролирующие биосинтез Б. и нуклеиновых кислот. К их числу относятся также пептидно-белковые гормоны. Информация о состоянии внешней среды, разл. регуляторные сигналы воспринимаются клеткой с помощью рецепторных Б., располагающихся на наружной поверхности плазматич. мембраны. За передачу сигналов внутрь клетки ответственны Б. сигнальных систем ($\ce{G}$-белки, Б.-эффекторы), которые играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксис). В активном транспорте ионов, липидов, сахаров и аминокислот через биологич. мембраны участвуют транспортные Б., или Б.-переносчики. Среди них, напр., гемоглобин и миоглобин, осуществляющие перенос кислорода. Основу костной и соединит. тканей, шерсти, роговых образований составляют структурные Б. (в т. ч. коллаген, кератин, эластин). Они же формируют клеточный скелет и межклеточный матрикс. Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве Б. сократительной системы (актина, миозина, тропомиозина, тубулина и др.). Б. – важнейшая составная часть пищи человека и кормов животных. Особое значение при этом имеют запасные Б. растений и животных (напр., казеин, проламины). Преобразование и утилизация энергии, поступающей в организм с пищей, а также энергии солнечного излучения происходят при участии Б. биоэнергетической системы (напр., родопсина, цитохромов). Среди пептидно-белковых веществ имеются антибиотики (в т. ч. грамицидины, полимиксины, энниатины), токсины и др. биологически активные вещества.
Классификация
Б. делят на простые, состоящие только из аминокислотных остатков, и сложные. Последние могут включать ионы металла (металлопротеины) или пигменты (хромопротеины), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины), а также ковалентно связывать остаток фосфорной кислоты (фосфопротеины), углевода (гликопротеины) или нуклеиновой кислоты (геномы некоторых вирусов). В соответствии с формой молекул Б. подразделяют на глобулярные и фибриллярные. Молекулы первых свёрнуты в компактные глобулы сферической или эллипсоидной формы, молекулы вторых образуют длинные волокна (фибриллы) и высоко асимметричны. Большинство глобулярных Б., в отличие от фибриллярных, растворимы в воде. Особую группу составляют мембранные Б., характеризующиеся неравномерным распределением гидрофильных и гидрофобных (липофильных) участков в молекуле: часть их полипептидной цепи, погружённая в мембрану, состоит в осн. из гидрофобных аминокислотных остатков, а выступающая из мембраны – из гидрофильных.
Структура белков
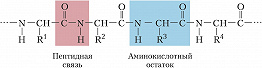
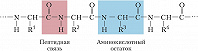
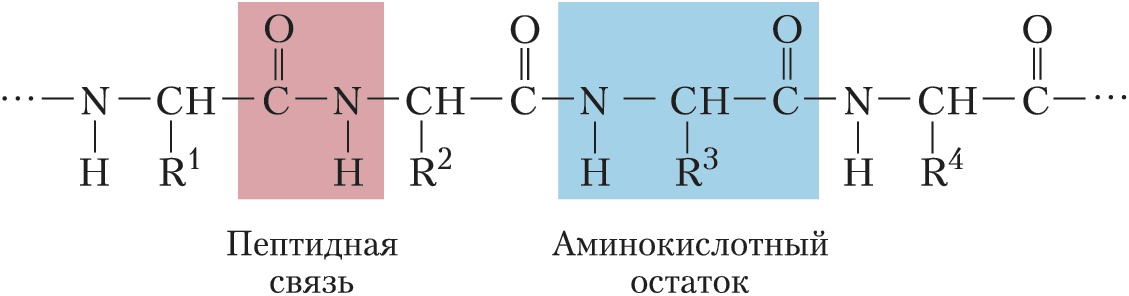
Практически все Б. построены из 20 $\ce{L-α}$-аминокислот, которые соединены между собой пептидной связью, образованной карбоксильной и $α$-аминогруппой соседних аминокислотных остатков:
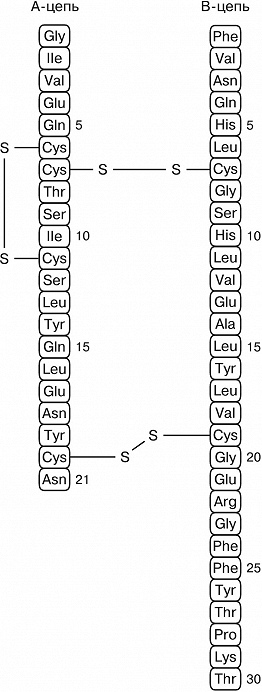
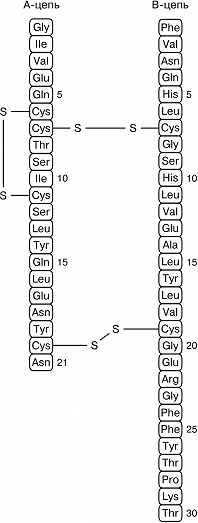
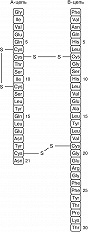
Белковая молекула может состоять из одной или нескольких полипептидных цепей (субъединиц), содержащих от 50 до нескольких сотен (иногда более тысячи) аминокислотных остатков. Молекулярная масса Б. от 5000 до неск. миллионов. Молекулы, содержащие менее 50 остатков, обычно относят к пептидам. В состав многих Б. входят остатки цистина, дисульфидные связи которых ковалентно связывают участки одной или нескольких цепей.
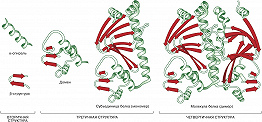
Различают четыре уровня организации белковых молекул. Последовательность аминокислотных остатков в полипептидной цепи называют первичной структурой (рис. 1). Все Б. различаются по первичной структуре, и потенциально возможное их число практически неограниченно. Генетич. информация о первичной структуре Б. заключена в его гене, который представляет собой последовательность нуклеотидов в молекулах ДНК или РНК. Каждой аминокислоте соответствует триплет (смысловой кодон) нуклеотидов, однозначно определяющий в процессе биосинтеза Б. её местоположение в полипептидной цепи. Часто после синтеза Б. подвергается дополнит. химич. превращениям – посттрансляционным модификациям. Вся информация, необходимая для формирования структур более высоких уровней, заложена в первичной структуре. Она содержит также некоторые участки, выполняющие самостоятельную роль в функционировании Б. Так, аминокислотные последовательности секретируемых Б. включают богатый гидрофобными аминокислотами сигнальный пептид (примерно 20–30 остатков), который обеспечивает перенос Б. через мембрану, после чего отщепляется.
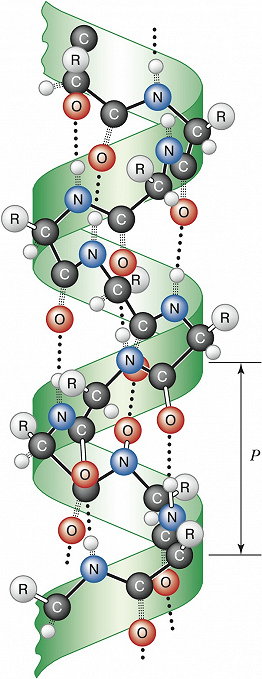
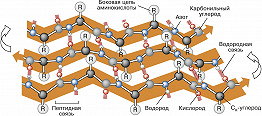
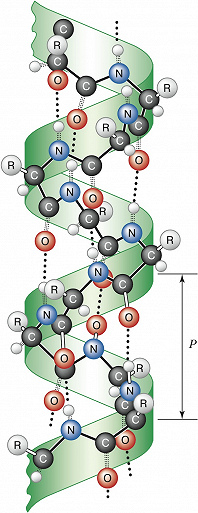
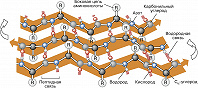
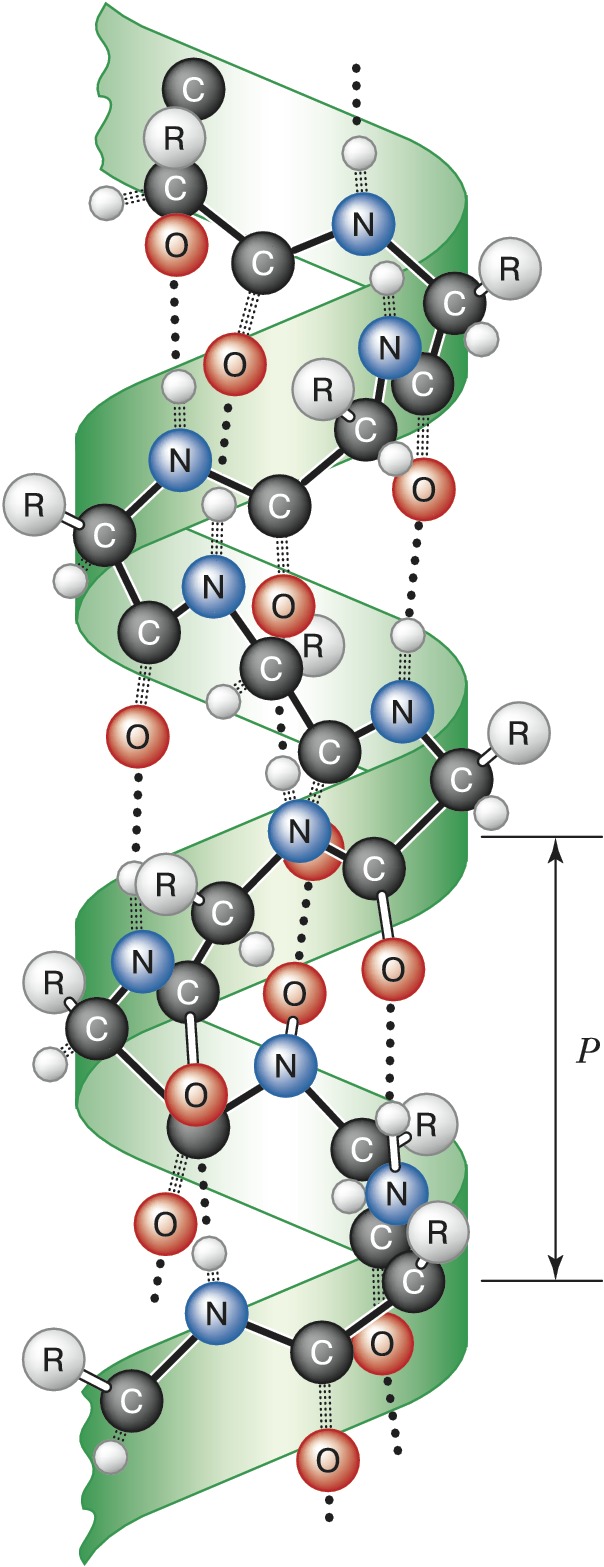
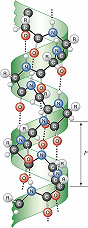
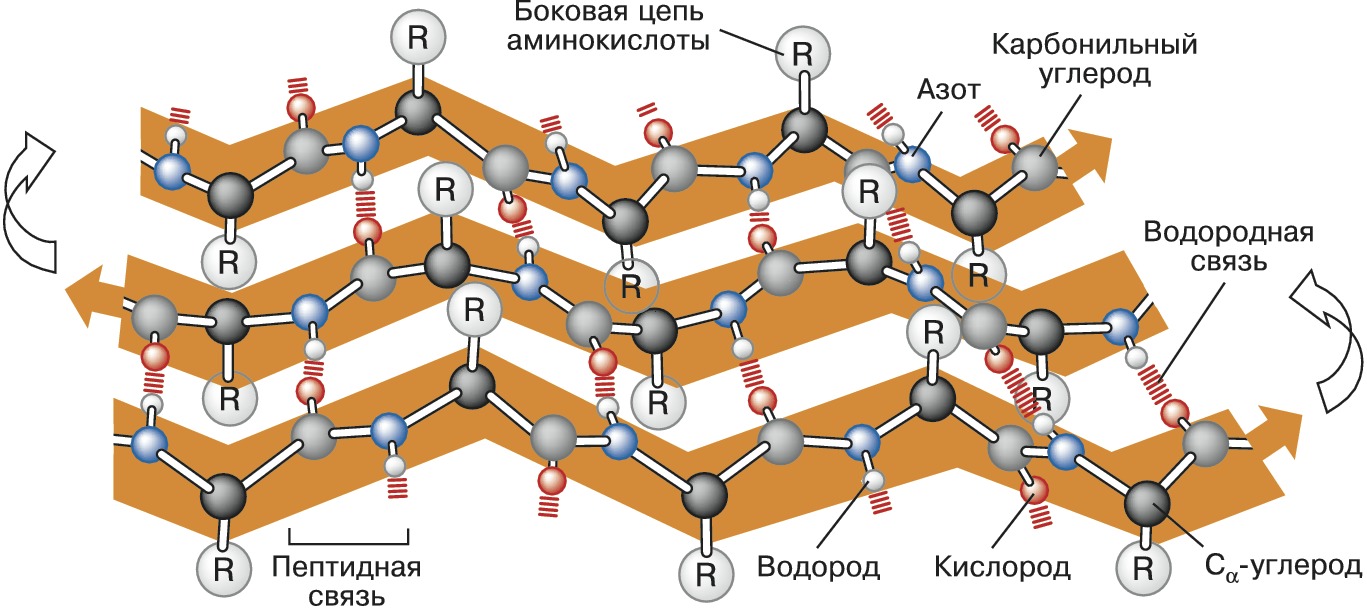
Вторичная структура – способ пространственной укладки участков полипептидной цепи (без учёта ориентации боковых групп). Для Б. особенно характерны периодические (канонические) элементы вторичной структуры: правая $α$-спираль и $β$-структура, стабилизированные водородными связями между $\ce{CO}$- и $\ce{NH}$-группами пептидной цепи. Первая характеризуется планарностью пептидной группы; на 1 виток $α$-спирали приходится 3,6 остатков аминокислот, шаг спирали $P$ – 0,544 нм (рис. 2). Иногда в Б. встречаются правые спирали, содержащие 3 аминокислотных остатка на 1 виток. Эти спирали гораздо менее энергетически выгодны, чем $α$-спирали; они представлены короткими участками, которые обычно располагаются на концах $α$-спиралей. В случае $β$-структуры, или структуры складчатого листа, полипептидные цепи растянуты, уложены параллельно друг другу и связаны между собой водородными связями. Остов цепи не лежит в одной плоскости, а вследствие небольших изгибов при $α$-углеродных атомах образует слегка волнистый слой. Боковые группы располагаются перпендикулярно плоскости слоя. Для Б. характерны два вида $β$-структуры: с параллельным и антипараллельным направлением цепей (рис. 3). Частный случай $β$-структуры – $β$-изгиб, обеспечивающий поворот пептидной цепи на угол ок. 180° на протяжении отрезка, содержащего 4 аминокислотных остатка: 1-й и 4-й остатки соединены водородной связью.
Относительное содержание $α$-спиральных участков и $β$-структур в разных Б. может широко варьировать. Существуют Б. с преобладанием $α$-спиралей (ок. 75% всех аминокислотных остатков в миоглобине и гемоглобине), тогда как осн. типом структуры мн. фибриллярных Б. (напр., фибрина и кератина) является $β$-структура. У мн. Б. содержание $α$- и $β$-структурных участков незначительно. Фрагменты полипептидных цепей, не образующие каноническую вторичную структуру, укладываются в пространстве строго определённым, характерным для каждого Б. образом и, следовательно, им свойственна специфическая вторичная структура. Будучи основана на ближних взаимодействиях, она в значит. мере определяется аминокислотной последовательностью соответствующего фрагмента Б., что делает возможным её теоретич. предсказание с определённой степенью вероятности. Однако на её формирование могут существенно влиять дальние взаимодействия. Так, $β$-структура может объединять неск. расположенных параллельно или антипараллельно отрезков, переставая быть локальным образованием и превращаясь в протяжённую супервторичную структуру. В $α$-кератине три $α$-спирали закручиваются относительно друг друга, образуя супер-$α$-спираль. Часто участки супервторичной структуры объединяют как $α$-спиральные участки, так и участки $β$-структуры, образуя структуры типа $βαβ$ (напр., в аминопептидазах), $αβαβ$ (в амилазах), $βαβαβαββ$ (в кетоацилтиолазах) и т. п.
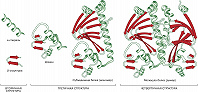
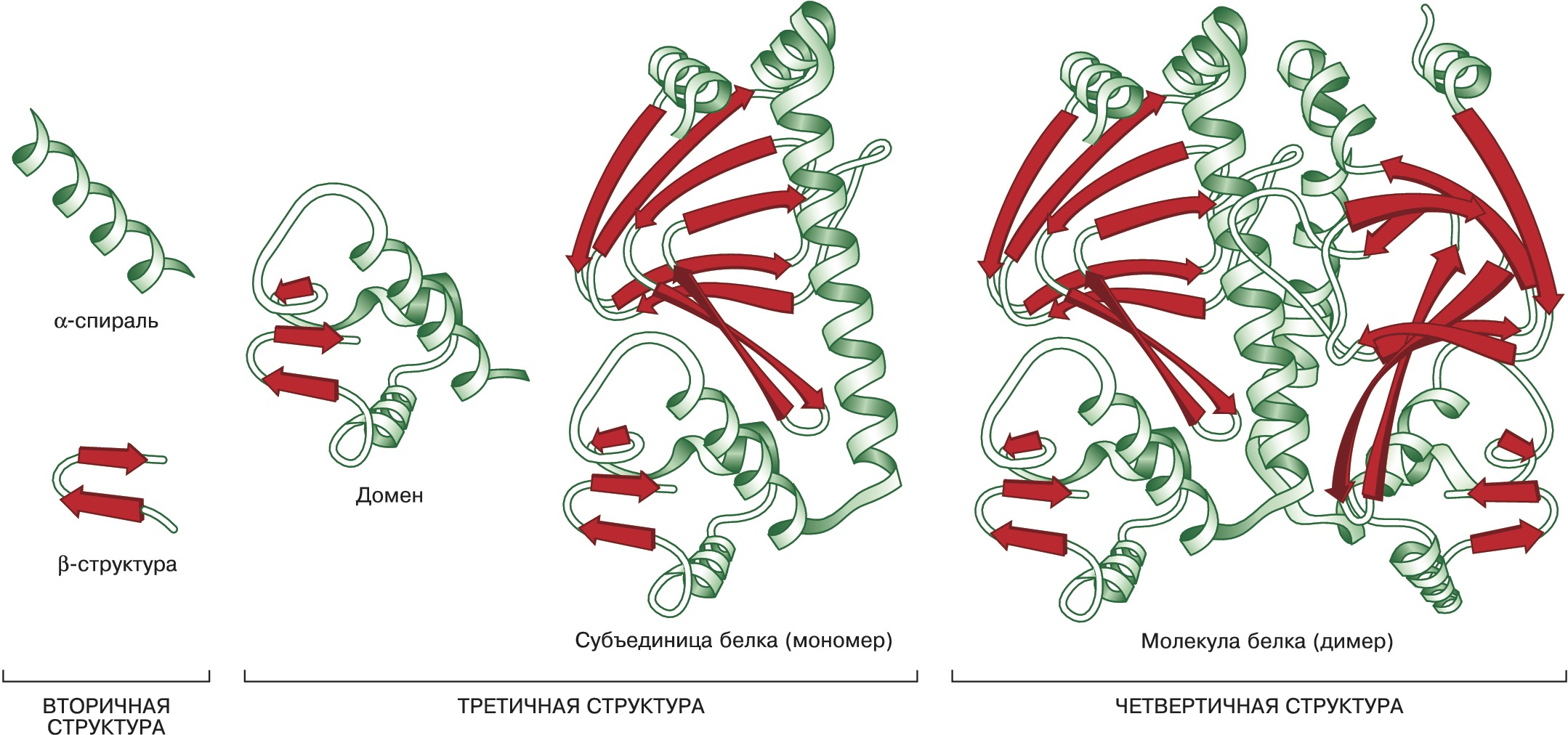
Под третичной структурой Б. понимают расположение в пространстве всех атомов белковой молекулы (рис. 4). При этом не учитывают её взаимодействия с соседними молекулами. Третичная структура формируется самопроизвольно и стабилизируется системой нековалентных взаимодействий – водородными, ионными, ион-дипольными, диполь-дипольными, вандерваальсовыми связями, а также гидрофобными взаимодействиями между боковыми цепями неполярных аминокислотных остатков. Как правило, внутри глобулы глобулярных Б. расположены боковые цепи гидрофобных аминокислот, собранные в ядро, а полярные группировки располагаются на её поверхности в гидратированном состоянии. Однако связывание Б. с др. молекулами, напр. фермента с его субстратом или коферментом, почти всегда осуществляется с помощью небольшого гидрофобного участка, расположенного либо на поверхности, либо в спец. впадине или щели глобулы.
Третичная структура белка соответствует его первичной структуре. Однако один и тот же способ укладки цепи в пространстве соответствует целому семейству первичных структур эволюционно родственных Б., в которых совпадать может всего лишь 20–30% аминокислотных остатков. Эти неизменяемые (консервативные) остатки определяют положение точек изгиба полипептидной цепи, а также др. существенно важные особенности конформации, и в частности активные центры ферментов, зоны связывания других биологич. молекул, эффекторные центры Б. и т. д. Нарушение третичной структуры Б. (денатурация) неизменно приводит к утрате их функции. Третичная структура мн. Б. формируется из нескольких компактных, независимо образованных областей – доменов, которые могут обладать и функциональной автономией, будучи ответственными за те или иные виды биологич. активности. Между собой домены обычно связаны «тонкими перемычками» – вытянутыми участками полипептидной цепи. Пептидные связи в этих участках при обработке протеолитич. ферментами расщепляются в первую очередь, тогда как отдельные домены обычно относительно устойчивы к протеолизу. Факторы, стабилизирующие третичную структуру Б., почти компенсированы факторами, противодействующими свёртыванию полипептидной цепи в компактную глобулу, поэтому пространственная структура Б., как правило, лабильна. Третичная структура подвижна: отд. участки молекулы Б., в особенности петли и домены, могут смещаться, что приводит к конформационным переходам, которые играют значит. роль во взаимодействии Б. с др. молекулами, облегчая образование комплементарных поверхностей.
Четвертичная структура – пространственный ансамбль нескольких (чаще всего 2–6) взаимодействующих между собой субъединиц, представленных отд. полипептидными цепями Б. (рис. 4). Такой уровень организации характерен для мн. Б. Между собой отд. субъединицы соединены водородными и ионными связями, гидрофобными взаимодействиями и др. Изменение рН и ионной силы раствора, повышение темп-ры или обработка детергентами обычно приводит к диссоциации макромолекул на субъединицы. В большинстве случаев этот процесс обратим: при устранении факторов, вызывающих диссоциацию, происходит самопроизвольная реконструкция исходной четвертичной структуры. Некоторые Б. способны образовывать структуры более высоких порядков, напр. полиферментные комплексы, протяжённые структуры (Б. оболочек бактериофагов) и т. п. Осн. функция четвертичной структуры состоит в том, чтобы относительно слабые зоны межсубъединичных контактов, легко реагирующих на изменения третичной структуры субъединиц или на присоединение тех или иных веществ – эффекторов, способны были передавать эти изменения на др. субъединицы. На этом основана кооперативность действия мн. Б., регуляция их активности за счёт взаимодействий с веществами, не имеющими структурного сходства с субстратом данного Б. Так, конечный продукт, образующийся в цепи ферментативных реакций, может управлять активностью первого её звена, что позволяет приостановить затрату исходных соединений, если накопилось достаточное количество конечного продукта. Примером функционирования четвертичной структуры могут служить гемоглобины, в которых поочерёдно протекают реакции присоединения и отщепления кислорода, в зависимости от его концентрации в крови и наличия таких эффекторов, как $\ce{H^{+},\, CO_2,\, Сl^{–}}$ или фосфоглицерат.
Методы исследования структуры белков
Для определения первичной структуры Б. прежде всего разделяют его полипептидные цепи, затем определяют аминокислотный состав цепей, N- и С-концевые аминокислотные остатки и последовательность аминокислот. Полипептидные цепи подвергают специфич. расщеплению протеолитич. ферментами (напр., трипсином, который гидролизует связи по остаткам лизина и аргинина, или протеазой из Staphylococcus aureus, гидролизующей связи по остаткам глутаминовой кислоты) или химич. реагентами (напр., бромцианом, расщепляющим связи, образованные остатками метионина, гидроксиламином – между остатками аспарагина и глицина). Смесь образовавшихся фрагментов разделяют и для каждого из них определяют аминокислотную последовательность. Осн. методом исследования аминокислотной последовательности пептидов и белков является их деградация с помощью фенилизотиоцианата (метод Эдмана); при этом происходит последовательное отщепление N-концевых аминокислотных остатков в виде фенилтиогидантоинов, которые поглощают свет в УФ-области с максимумом поглощения 265–270 нм. С помощью спец. прибора – секвенатора – удаётся осуществить автоматич. отщепление и идентификацию фенилтиогидантоинов. Для этих же целей применяют масс-спектрометрию. В последние годы для установления первичной структуры Б. в осн. пользуются данными о последовательности нуклеотидов в их структурных генах. Для определения содержания канонич. элементов вторичной структуры в Б. используют методы кругового дихроизма и дисперсии оптич. вращения. О пространственном расположении атомов в молекуле Б. судят на основании рентгеноструктурного анализа его кристаллов. С помощью дифференциальной спектроскопии, спектроскопии комбинационного рассеяния и флуоресценции изучают изменение конформации Б. в процессе функционирования или при изменении внешних условий. Прямую информацию о пространственном строении Б. в растворе даёт метод ядерно-магнитного резонанса.
Физико-химические свойства
Молекулы Б. имеют массу от нескольких тысяч до 1 миллиона и выше. Константа седиментации варьирует от 1 до 20 и более. Средний удельный объём белковых молекул 0,70–0,75 см3/г. Молекулы Б. обладают слабой способностью к диффузии и не проходят через полупроницаемые мембраны. Максимум поглощения Б. в УФ-области спектра, обусловленный наличием в их молекулах ароматич. аминокислотных остатков, находится вблизи 280 нм. В ИК-области спектра Б. поглощают за счёт $\ce{COO}$- и $\ce{NH}$-групп при 1600 и 3100–3300 см–1. Растворимые Б. – гидрофильные коллоиды, активно связывающие воду. Б. – амфотерные электролиты, т. к. имеют свободные карбоксильные и аминные группы. Изоэлектрические точки у разных Б. колеблются от менее 1,0 (у пепсина) до 10,6 (у цитохрома c) и выше. Растворимость Б. также может существенно различаться. Одни Б. легко растворяются в воде, другим для растворения требуется наличие небольших концентраций солей, третьи переходят в раствор только под действием сильных щелочей или детергентов. Разные Б. неодинаково осаждаются из растворов органическими веществами (напр., спиртами) или высокими концентрациями солей (высаливаются). Существенные различия в растворимости и др. особенности используются при выделении индивидуальных Б. Белки дают ряд цветных реакций, обусловленных наличием определённых аминокислотных остатков или химических группировок. К важнейшим из них относятся биуретовая (реакция с биуретом, на пептидную связь) и нингидриновая (с нингидрином, на аминогруппу) реакции. Боковые группы аминокислотных остатков способны вступать во многие химические реакции. При этом реакционная способность одних и тех же группировок существенным образом зависит от положения в полипептидной цепи Б.: как от локализации группировки в общей пространственной структуре Б., так и от влияния соседних боковых групп. Наивысшей реакционной способностью обычно обладают группировки, расположенные в составе активного центра белка.
Получение белков
Разработаны методы выделения индивидуальных Б., основанные гл. обр. на хроматографии, включая аффинную, эксклюзионную, ионообменную и гидрофобную. Особенно продуктивно их применение в режиме высокоэффективной жидкостной хроматографии. Широко используются также ультрафильтрация, электрофорез и др. Критериями чистоты Б. являются гомогенность при электрофорезе, хроматографии и ультрацентрифугировании. У Б., состоящего из одной полипептидной цепи, она устанавливается при анализе N-концевой аминокислоты.
Для получения пептидов, в т. ч. гормонов и их разнообразных аналогов, а также пептидов, несущих антигенные детерминанты разл. Б. и используемых для приготовления соответствующих вакцин, широко применяется химич. синтез. Осуществлён химич. синтез некоторых небольших Б., однако эта очень трудоёмкая процедура до сих пор имеет скорее теоретическое, чем практическое значение. Б., имеющие пром. значение (ферменты, гормоны, цитокины, интерфероны), синтезируются с помощью технологии рекомбинантных ДНК (генетической инженерии) в чужеродных организмах и являются продуктами биотехнологич. производств. Методы белковой инженерии позволяют целенаправленно изменять структуру белков.