КОНФОРМАЦИО́ННЫЙ АНА́ЛИЗ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
КОНФОРМАЦИО́ННЫЙ АНА́ЛИЗ, раздел стереохимии; изучает конформации молекул, конформационные равновесия, а также зависимости физических, химических, биологических и др. свойств веществ от их конформационного поведения. Основы К. а. заложены в 1940–1950-х гг. О. Хасселем и Д. Бартоном (Нобелевская пр., 1969); термин «К. а.» введён Бартоном в 1950.
Большинство молекул являются динамическими системами, в которых постоянно происходят как сравнительно небольшие изменения формы благодаря колебаниям атомов, так и более существенные превращения, обусловленные внутр. вращением вокруг простых связей, инверсией пирамидальных атомов (напр., атомов азота) и др. (см. Нежёсткие молекулы). При изменении относительной ориентации частей молекулы в результате внутр. вращения атомов или групп атомов вокруг простых связей, искажения валентных углов, растяжения или сжатия связей и др. внутримолекулярных деформаций, проходящих без разрыва или образования новых химич. связей, возникают разл. пространственные формы молекулы – конформации (от лат. conformatio – форма, построение, расположение). Разные конформации могут отличаться энергией внутреннего напряжения молекул. Конформации, отвечающие локальным минимумам энергии, обычно называют конформерами или конформационными изомерами (иногда – поворотными изомерами), переходы между ними – конформационные переходы – связаны с преодолением энергетич. барьера внутреннего вращения молекул. Если молекула способна существовать в виде нескольких конформеров, между ними наблюдается равновесие. Относительная стабильность конформеров (а следовательно, и их соотношение в равновесии) обусловлена различием в их энергии напряжения, определяемой гл. обр. внутримолекулярными взаимодействиями. Конформационные превращения характерны для разл. химич. соединений – от простейших молекул (пероксида водорода, аммиака) до макромолекул (синтетич. полимеров, белков, нуклеиновых кислот). Для решения осн. задач К. а. используют спектральные методы, рентгено- и электронографию, измерения дипольных моментов и др. диэлектрических характеристик, теоретич. расчёты (методами квантовой химии, молекулярной механики и пр.).
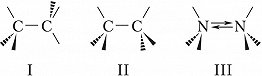
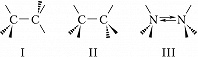
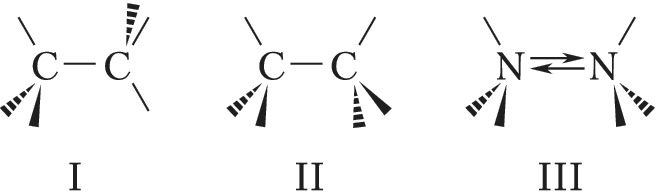
Ациклические органич. соединения, содержащие хотя бы одну простую связь С С или С гетероатом, обычно существуют в виде равновесной смеси нескольких конформеров. Для этана наиболее стабильными являются т. н. скошенные конформации (формула I); переход из одной скошенной конформации в другую происходит при вращении вокруг простой СС-связи через заслонённую конформацию (II), соответствующую максимуму энергии. Для 1,2-дизамещённых этанов наблюдается неск. конформеров – гош- и транс- (или анти-). Пирамидальная инверсия характерна для таких соединений, как, напр., аммиак и амины (III).
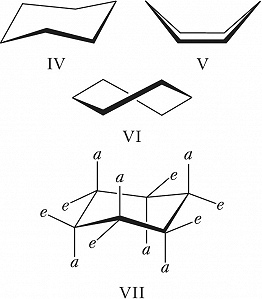
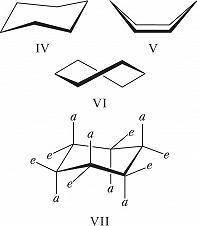
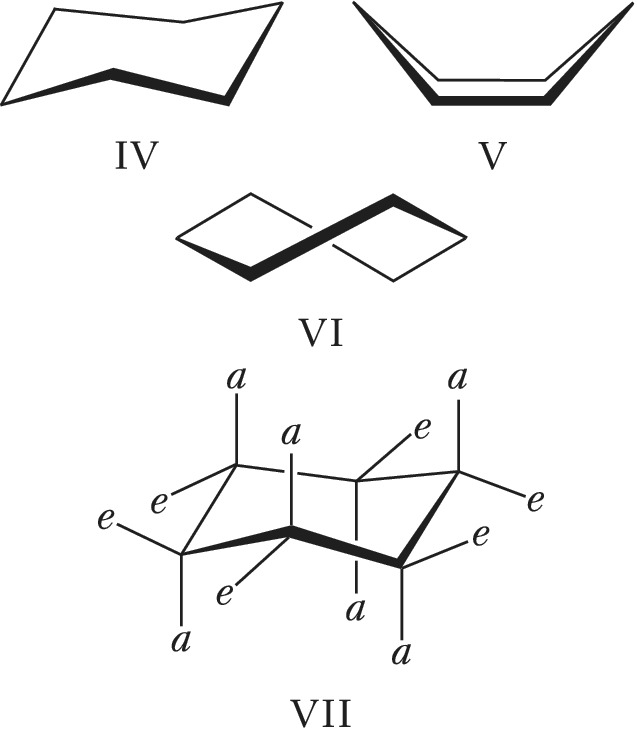
Циклические молекулы обладают меньшей конформационной подвижностью по сравнению с ациклическими. Для замещённых циклогексанов обычно рассматривают три свободные от угловых напряжений конформации – кресло (IV), ванна (V) и твист-ванна (VI); наиболее стабильной для самого циклогексана является конформация кресло, конформации ванна и твист-ванна за счёт взаимодействия валентно-несвязанных атомов водорода имеют более высокую энергию и их доля в равновесии пренебрежимо мала, причём конформация твист-ванна отвечает локальному минимуму энергии, а ванна является энергетич. максимумом при взаимопревращениях твист-конформеров. В конформации кресло заместители могут занимать как аксиальные, так и экваториальные положения (VII; a – аксиальные, e – экваториальные связи); при инверсии заместители, занимавшие аксиальные положения, становятся экваториальными, и наоборот. Практически для всех заместителей в монозамещённых циклогексанах экваториальное положение является предпочтительным. Конформационное поведение ди- и полизамещённых циклогексанов сложнее и зависит также от взаимодействия заместителей, определяемого их природой и расположением.
Конформационное поведение, необъяснимое в рамках классич. структурных теорий, обычно называют конформационным эффектом, напр. аномерный эффект в углеводах (бóльшая устойчивость аксиального конформера при наличии в молекуле электроотрицательных заместителей по соседству с гетероатомом), эффект «хоккейных клюшек» (изменение «обычной» ориентации заместителей за счёт отталкивания свободных электронных пар гетероатомов).
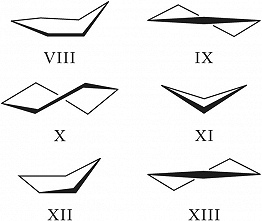
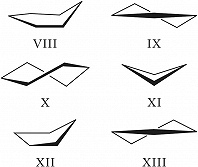
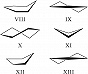
Конформации шестичленных циклических молекул в системе т. н. координат складчатости могут быть представлены на поверхности сферы: на полюсах – конформации кресло и инвертированное кресло, на экваторе – чередующиеся через 30° конформации ванна и твист-ванна с разл. нумерацией атомов. Между конформациями кресло и ванна расположены конформации полуванна (или конверт) (VIII), имеющие пять атомов в одной плоскости; между конформациями кресло и твист-ванна – полукресло (IX) и 1,3-дипланарная (X). Наиболее выгодной для циклогексена является конформация полукресло. Для циклобутанов предпочтительными являются две складчатые конформации (XI), между которыми наблюдается инверсия. Циклопентаны существуют в конформациях конверт (XII) и твист (XIII), исключительно легко переходящих друг в друга при последовательном отгибании каждого атома цикла как «вверх», так и «вниз» (в результате возникают десять конформаций конверт и десять твист-конформаций с разл. нумерацией атомов); это явление носит назв. «псевдовращение».
Относительная стабильность конформеров в значит. степени зависит от внешних факторов. Существенное влияние на конформационное равновесие оказывает природа растворителя: в полярных растворителях равновесие обычно сдвигается в сторону конформаций с бóльшим дипольным моментом, в неполярных – с мeньшим. Равновесие может зависеть от pH среды, от способности растворителя образовывать водородные связи с молекулами растворённого вещества, от температуры и др. В твёрдой фазе молекулы обычно существуют в виде единственного конформера, в жидкой и газовой фазах наблюдается равновесие между конформерами.
Необходимость учёта конформаций молекул возникает при рассмотрении стереохимич. закономерностей химич. реакций (см. Динамическая стереохимия). Разл. конформеры обладают неодинаковой реакционной способностью. Напр., циклогексен образуется из аксиального конформера бромциклогексана (транс- элиминирование), хотя в равновесии доминирует экваториальный конформер. Когда в реакции участвует неск. конформеров, каждый из которых может давать разл. продукты реакции, в общем случае соотношение продуктов определяется соотношением констант скоростей реакций и констант скоростей, отвечающих конформационным переходам (в соответствии с уравнением Зефирова). В частном случае, когда скорости реакций ниже, чем скорости конформационных взаимопревращений, для трактовки реакционной способности веществ широко используется принцип Кёртина – Гаммета, согласно которому относительные количества продуктов, образованных из двух конформеров, зависят только от разности свободных энергий переходных состояний и не зависят от относительной заселённости конформеров. Когда же скорости реакций выше, чем скорости конформационных взаимопревращений, соотношение продуктов определяется соотношением конформеров в момент начала реакции («конформационный контроль»).
При увеличении длины цепи из простых связей в молекуле число возможных конформеров очень быстро растёт (в насыщенных углеводородах, напр., вращение вокруг каждой простой CC-связи отвечает трём энергетич. минимумам). В результате полимерные молекулы существуют в форме статистического клубка. Вытягивание образцов некоторых полимеров приводит к тому, что молекулы приобретают ориентированные в направлении растяжения конформации, что увеличивает межмолекулярные взаимодействия и механич. прочность образца.
Молекулы белков и нуклеиновых кислот (в отличие от синтетич. полимеров) несмотря на очень большие размеры принимают в биологич. объектах строго определённый набор конформаций; конформационная самоорганизация цепей биополимеров – фолдинг (от англ. to fold – складывать) – чрезвычайно важна для функционирования живых организмов. Пространственные структуры десятков тысяч белков исследованы эксперим. методами и служат основой для компьютерного моделирования белков с неизвестной пространственной структурой.