ПОВЕ́РХНОСТНАЯ ЭНЕ́РГИЯ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
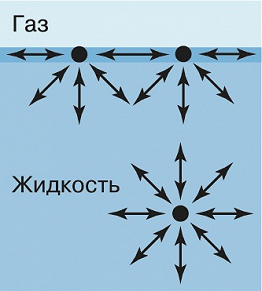
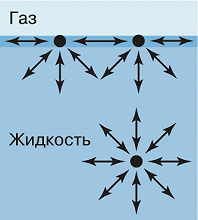
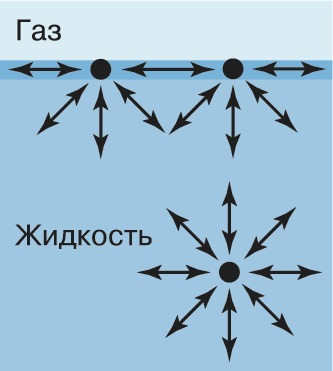
ПОВЕ́РХНОСТНАЯ ЭНЕ́РГИЯ, энергия молекул, атомов, ионов, находящихся в тонком переходном слое, расположенном в непосредственной близости от границы раздела двух и более фаз, имеющая более высокое положительное значение по сравнению с энергией молекул, атомов, ионов, находящихся в аналогичном объёме, расположенном внутри фазы. Повышенный уровень энергии на поверхности фазы является следствием избыточной потенциальной (свободной) энергии молекул, атомов или ионов, находящихся в поле действия несимметричных сил притяжения и реализующих лишь часть возможных взаимодействий (образования ковалентных, ионных, донорно-акцепторных, ван-дер-ваальсовых и пр. связей), а также наличия избыточной кинетической (тепловой) энергии, вызванной большей подвижностью (бóльшим количеством степеней свободы) молекул, атомов, ионов, расположенных в поверхностном слое. Равнодействующая сил, оказывающих влияние на молекулу в поверхностном слое, направлена внутрь жидкости, тогда как взаимодействие молекулы с соседними в объёме примерно равноценно (рис. 1).
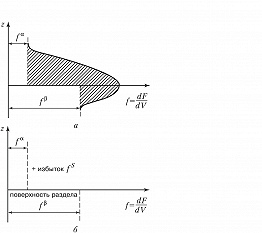
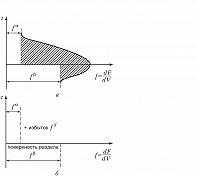
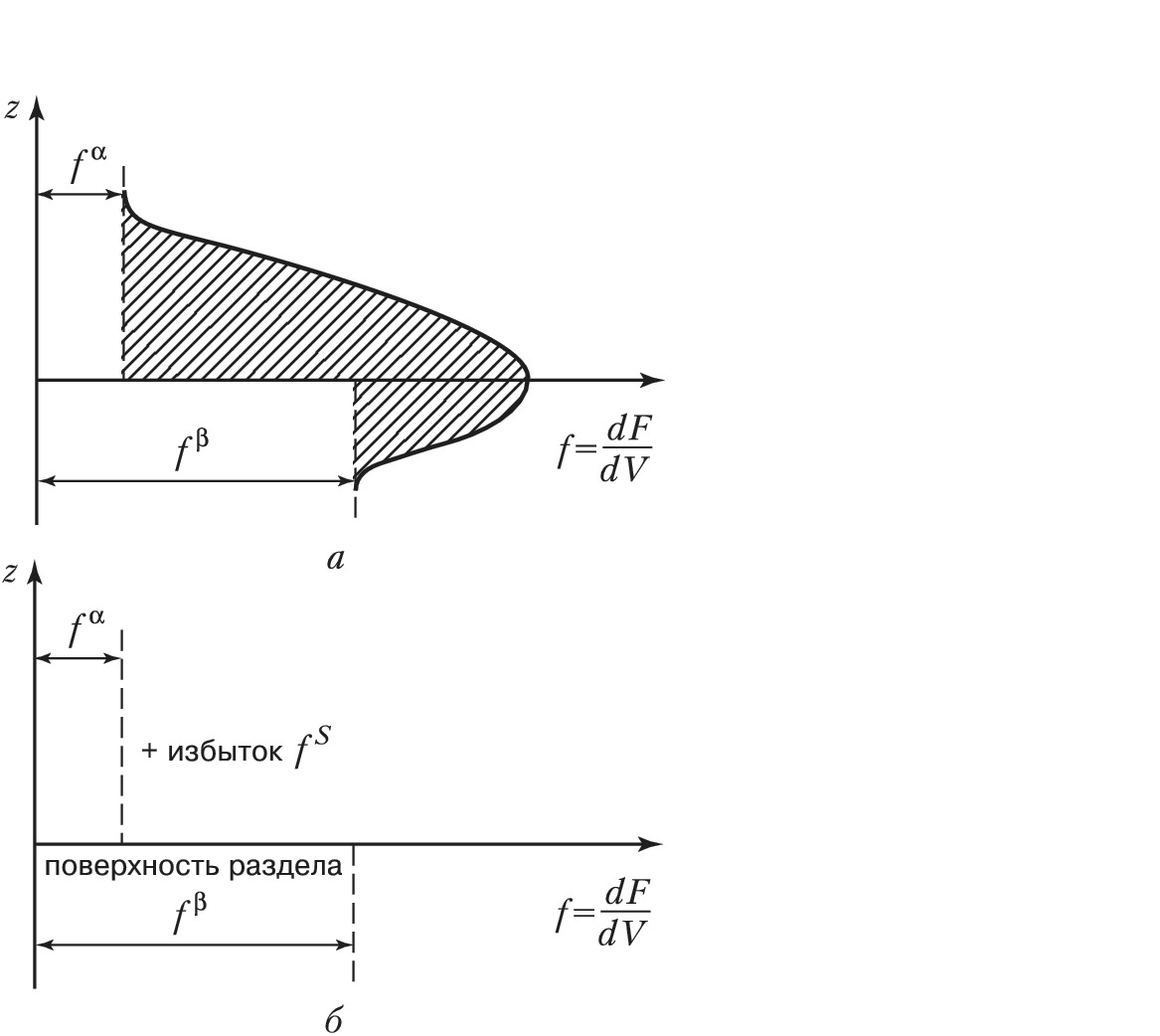
П. э. равновесной системы может быть выражена с использованием всех известных термодинамич. функций. Как и др. виды энергии, П. э. является экстенсивной величиной и пропорциональна площади границы раздела фаз. Количественно П. э. определяется интегральным выражением, учитывающим собств. энергию всех атомов, молекул, ионов, принадлежащих переходному слою. В частности, интегральная величина изохорно-изотермич. потенциала (свободной энергии, см. Гельмгольца энергия) $F$, выраженная через плотность свободной энергии $\left( \frac{dF}{dV} \right)_{V\rightarrow 0}=f$, может быть представлена как $F=s \cdot\left( \int^0_{-\delta'}\left( \frac{dF}{dV}\right)dz+\int_0^{+\delta''}\left( \frac{dF}{dV}\right)dz \right)$ ($s$ – площадь поверхности раздела фаз, $V$ – объём). Использование этого выражения требует знания не только толщин переходных слоёв со стороны каждой из контактирующих фаз ($δ′$ и $δ″$), но и информации о характере зависимости энергии от расстояния ($z$) в поверхностном слое, которую предоставляет метод слоёв конечной толщины.
Более простым способом описания термодинамич. свойств поверхности является метод избыточных величин Гиббса, согласно которому имеется идеализированная система, состоящая из двух фаз ($α$ и $β$) с разделяющей поверхностью, которой свойственны избытки термодинамич. характеристик – энергии, энтропии и содержания компонентов (рис. 2). В этом случае в термодинамич. уравнениях фигурируют не абсолютные, а избыточные экстенсивные величины. Напр., избыток числа молей компонентов на поверхности выражается уравнением: $\Delta n_i=n_i-n_i^{\alpha}\cdot V_i^{\alpha}-n_i^{\beta}\cdot V_i^{\beta}=n_i^s$ ($n_i$ – число молей $i$-го компонента). Выражение для избыточной П. э. определяется как $F^s=F-F^{\alpha}-F^{\beta}=s\cdot \left( \int^0_{-\delta'}(f(z)-f^{\alpha})dz+\int_0^{+\delta''}(f(z)-f^{\beta})dz\right)$. Как видно из рисунка, при таком подходе величина П. э. оказывается зависящей от положения разделяющей поверхности.
Наличие нескомпенсированных сил притяжения на границе раздела приводит к появлению (наряду с избыточной П. э.) силы, направленной тангенциально, вдоль ограничивающего поверхность контура. Эта сила, называемая поверхностным натяжением σ, препятствует увеличению межфазной поверхности. К поверхностям, разделяющим конденсированные фазы, обычно применяется термин «межфазное натяжение».
Если, используя метод Гиббса, применительно к поверхностному слою записать уравнения 1-го и 2-го законов термодинамики для открытой двухфазной системы с учётом действия сил поверхностного натяжения, то может быть получено фундам. уравнение Гиббса: $dF^s=\sigma\cdot ds-S^s\cdot dT+\sum μ_i\cdot dn_i^s$ ($S$ – энтропия, $T$ – темп-ра, $μ_i$ – химич. потенциал $i$-го компонента). Из него следует, что поверхностное натяжение является частной производной свободной энергии (а также любого др. термодинамич. потенциала) по поверхности при постоянстве соответствующих переменных: $\left( \frac{\partial F^s}{\partial s}\right)_{T,V,\sum n_i}=\delta$. Для однокомпонентной фазы оно численно совпадает с величиной удельной свободной избыточной П. э., равной и противоположной по знаку работе образования единицы новой поверхности.
Рассчитать полную внутреннюю энергию поверхности $U_s$ по методу Гиббса можно, экспериментально определив величину поверхностного натяжения и его температурный коэф., который всегда отрицателен (что означает существование избытка энтропии в поверхностном слое): $U_s=\sigma-T \cdot \frac{\partial \sigma}{\partial T}$. Важно, что, в отличие от П. э. в методе избыточных величин, поверхностное натяжение в случае плоской границы раздела не зависит от выбора положения поверхности. Оно является характеристикой сил, действующих в поверхностном слое, и описывается интегралом тангенциальной компоненты тензора давления, которая отличается от гидростатич. нормального давления и является отрицательной величиной: $\sigma=\int_{-\delta'}^{+\delta''}[p-p(z)]dz$.
Если поверхность раздела оказывается искривлённой, действие сил поверхностного натяжения в поверхностном слое приводит к появлению разницы нормальных давлений в фазах, которая зависит от интенсивности действия сил поверхностного натяжения и от основных радиусов кривизны поверхности $r_1$ и $r_2$: $\Delta p=\sigma \left( \frac{1}{r_1}+\frac{1}{r_2}\right)$ или $\Delta p=\frac{2\sigma}{r}$ для сферич. поверхности капли. Это уравнение, известное как уравнение Лапласа, предсказывает наличие большого внутреннего давления в микроразмерных и особенно наноразмерных частицах. Удельная поверхность (т. е. отношение суммарной поверхности к объёму) таких частиц огромна, а значит, необычайно велик запас П. э. Поэтому любая микро- или нанодисперсия далеко не равновесна и переходит в более устойчивое состояние, напр., путём коагуляции, переконденсации или адсорбции.
На микро- и наноуровне поверхности твёрдых тел обычно шероховаты и энергетически неоднородны. Тем не менее их тоже характеризуют величиной П. э., определение которой возможно, напр., путём экстраполяции температурной зависимости поверхностного натяжения расплава, из данных смачивания (для аморфных тел), методом «залечивающейся царапины» или из работы раскалывания кристалла.
П. э. играет огромную роль в смачивании, растекании, адсорбции, капиллярных эффектах, получении и устойчивости дисперсных систем, а также определяет подходы к реализации мн. технологич. процессов.