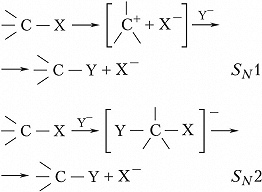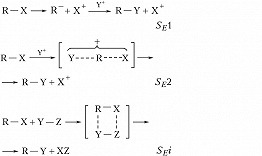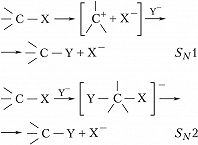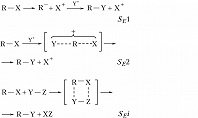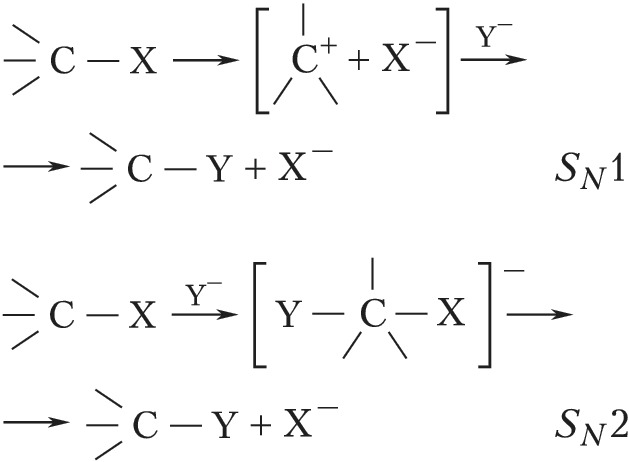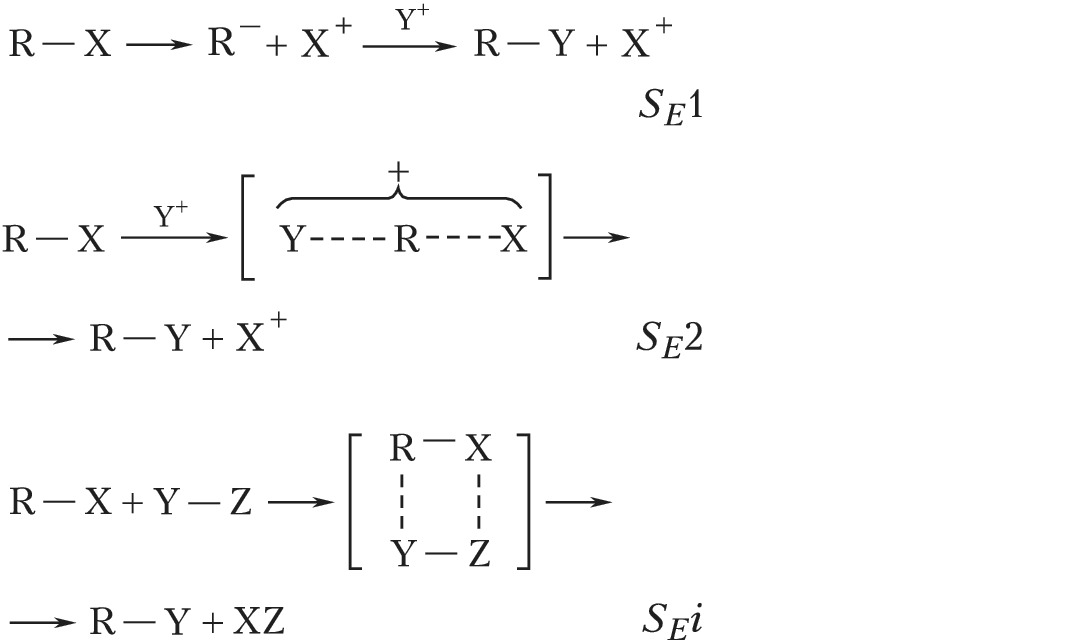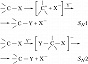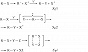НУКЛЕОФИ́ЛЬНЫЕ И ЭЛЕКТРОФИ́ЛЬНЫЕ РЕАГЕ́НТЫ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
НУКЛЕОФИ́ЛЬНЫЕ И ЭЛЕКТРОФИ́ЛЬНЫЕ РЕАГЕ́НТЫ, два типа реагентов в гетеролитических реакциях, различающиеся по характеру их участия в разрыве имеющихся или в образовании новых химич. связей.
К нуклеофильным реагентам или нуклеофилам (от лат. nucleus – ядро и ...фил) относят основания Льюиса: анионы (Cl–, Br–, I–, ОН–, CN–, NO2–, RO–, RS–, RCOO– и др.), нейтральные молекулы, обладающие свободной парой электронов (Н2О, NH3, R3N, R2S, R3P, ROH, RCOOH и др.), соединения с кратными связями, металлоорганич. соединения R─Me, способные генерировать карбанионы R–. Нуклеофилы в химич. реакциях отдают свою пару электронов на образование новой связи, атакуя субстрат по электронодефицитному центру. Реакция завершается присоединением нуклеофила или замещением им уходящей группы. Так, в реакциях типа Y–+RX→RY+X– частица Y– является нуклеофилом, а уходящую группу Х– принято называть нуклеофугом (от лат. fugio – убегать). На скорость и механизм нуклеофильных реакций влияют реакционная способность нуклеофила (нуклеофильность), реакционная способность уходящей группы Х– (нуклеофугность), природа субстрата и условия реакции (темп-ра, растворитель, давление и т. д.). Нуклеофильность измеряется относит. константами скорости реакций разл. нуклеофильных реагентов по отношению к общему субстрату. Практически всегда анионы ОН–, CN–, RS–, I– и Вr– проявляют себя как сильные нуклеофилы, а Н2О, СН3ОН, F–, NO3–, SО42– – как слабые.
Возможны два механизма реакций нуклеофильного замещения – мономолекулярный SN1 (двухстадийный – удаление одного заместителя и присоединение другого происходит поочерёдно) и бимолекулярный (синхронный) процесс SN2 (одностадийный – удаление одного заместителя и присоединение другого происходит одновременно):
Механизм SN1 реализуется в полярных растворителях (Н2О, СН3ОН, СН3СООН и др.), способствующих гетеролизу связи С─Х, и в реакциях с субстратами, содержащими третичный, аллильный или бензильный атом С. Процессы с механизмом SN2 меньше зависят от природы растворителя, они характерны для субстратов с первичным атомом С. При мономолекулярном процессе первоначально под действием растворителя происходит ионизация субстрата с образованием трёхкоординационного карбкатиона и нуклеофуга (эта стадия является лимитирующей и определяет скорость всего процесса), затем следует быстрая стадия связывания карбкатиона с нуклеофилом. Атака нуклеофила равновероятна с обеих сторон, поэтому в случае асимметрического реакционного центра образуются рацематы. В бимолекулярном процессе формируется пятикоординационное переходное состояние, причём атака нуклеофила осуществляется со стороны, противоположной уходящему заместителю, что приводит к обращению конфигурации.
Нуклеофильное замещение в алифатич. ряду (гидролиз, алкоголиз, ацидолиз, аминирование и т. д.) имеет исключительно важное значение для органич. синтеза, позволяя целенаправленно заменять функциональные группы, а также конструировать углеродный скелет молекулы путём использования C-нуклеофилов (напр., металлоорганич. соединений).
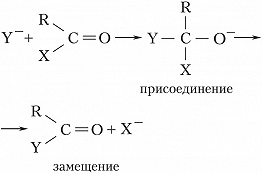
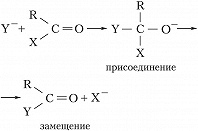
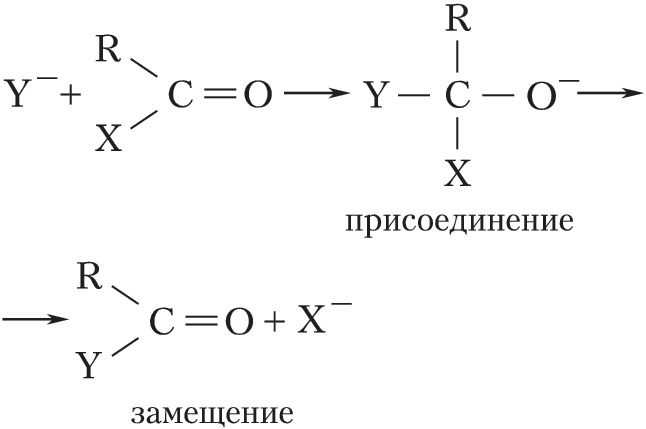
Наиболее важны для органич. синтеза реакции нуклеофильного присоединения и замещения у карбонильного атома углерода:
В некоторых случаях процесс останавливается на стадии присоединения (напр., в реакциях HCN с альдегидами и кетонами с получением циангидринов). В др. случаях (когда Х– хороший нуклеофуг) образуются продукты замещения. К этому типу процессов относят, напр., реакции этерификации: RCOOH+ R′OH⇄ RCOOR′+ Н2О (происходят при кислотном катализе).
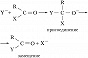
К электрофильным реагентам или электрофилам (от электрон и ...фил) относят катионы и молекулы, имеющие достаточно низкую по энергии вакантную орбиталь, – кислоты Льюиса (Н+, D+, Li+, R+, Cl+, Br+, SO3H+, NO2+, HCl, H2SO4, BF3, AlCl3 и др.). При реакции с субстратом электрофилы принимают электронную пару на незаполненную орбиталь и вытесняют уходящую группу в виде положительно заряженной частицы. В реакциях типа Y++RX→RY+X+ электрофилом является частица Y+, а Х+ (уходящую электронодефицитную группу) называют электрофугом. В реакции с электрофилами вступают алкены, алкины и ароматич. соединения, имеющие стерически доступные центры с повышенной электронной плотностью. Реакционная способность электрофильного реагента измеряется относит. константами скорости реакций разл. электрофильных реагентов по отношению к общему субстрату. Сильными электрофилами являются NO2+, H2OCl+, HSO3+, H2S2O7, комплексы Cl2 или Br2 с разл. кислотами Льюиса (FeCl3, AlBr3, AlCl3, SbCl5 и т. д.) и др.; примеры слабых электрофилов – катион диазония C6H5N2+, катион нитрозония NO+, диоксид углерода СО2.
Возможны три механизма реакций электрофильного замещения: мономолекулярный SE1 и бимолекулярные SE2 и SEi (обозначение используется для бимолекулярных реакций с т. н. внутренним содействием, когда реагент состоит из электрофильной и нуклеофильной частей):
В мономолекулярном процессе SE1 субстрат ионизируется с образованием карбаниона (эта стадия обычно определяет скорость реакции), который затем быстро реагирует с электрофилом. В ходе реакций по этому механизму происходит, как правило, рацемизация. В бимолекулярных реакциях, протекающих по механизмам SE2 и SEi, возможна атака электрофила со стороны уходящей группы (при этом конфигурация субстрата сохраняется) или с противоположной стороны (конфигурация обращается). Повышение полярности растворителя увеличивает возможность ионизации в реакциях, протекающих по механизму SE1, а также ускоряет реакции типа SE2, тогда как на реакции типа SEi влияет гораздо меньше. Большое значение имеет природа электрофуга. В случае карбкатионных электрофугов наблюдается механизм SE1, тогда как для металлсодержащих групп – SE2 или SEi. Заместители в субстрате, обладающие отрицательным индуктивным и мезомерным эффектами, ускоряют реакции типа SE1. Реакции типа SE2 также ускоряются при наличии заместителей с отрицательным индуктивным эффектом и замедляются при наличии заместителей с положительным индуктивным эффектом.
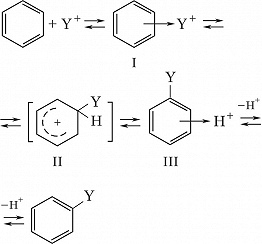
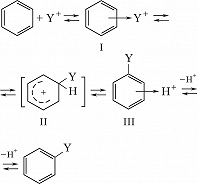
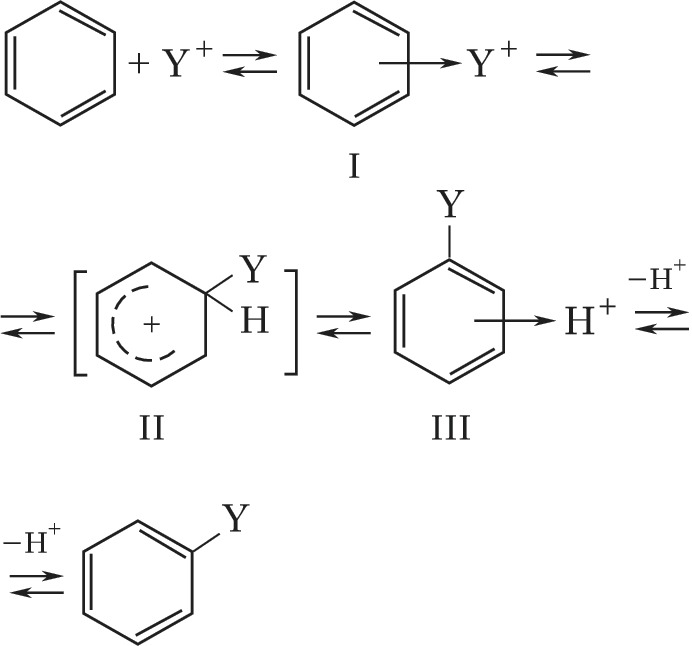
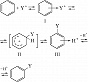
Электрофилы вступают в один из важнейших типов реакций – электрофильное замещение в ряду ароматич. соединений (галогенирование, нитрование, сульфирование, ацилирование по Фриделю – Крафтсу и др.). В начальной стадии
электрофил Y+ образует с ароматич. субстратом промежуточный π -комплекс (I), в котором Y+ расположен над плоскостью кольца, затем формируется т. н. σ-комплекс (II, формирование σ-комплекса является, как правило, лимитирующей стадией), превращающийся в конечный продукт, иногда через образование π-комплекса (III):
Соединения с кратными связями вступают с электрофилами в реакции электрофильного присоединения (см. в ст. Присоединения реакции).
Термины «нуклеофильный» и «электрофильный» используются также для указания на кажущийся полярный характер некоторых радикалов, о котором можно судить по их более высокой реакционной способности по отношению к реакционным центрам соответственно с пониженной или с более высокой электронной плотностью.