КЛА́СТЕРНЫЕ СОЕДИНЕ́НИЯ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
КЛА́СТЕРНЫЕ СОЕДИНЕ́НИЯ, комплексные соединения, содержащие неск. атомов металла М, непосредственно связанных между собой сильными или слабыми химич. связями $М─М$. Ядро из атомов металлов называют кластерным ядром. К. с. часто называют кластерами. Полиядерное комплексное соединение ($\ce{Ta_6Cl_{14}·7H_2O}$) впервые было описано в 1907. К. с. известны для большинства химич. элементов, но наиболее характерны для переходных $4d$- и $5d$-металлов. Обычно связи $\ce{М-М}$ образуют металлы в низких степенях окисления.
Известны К. с. гомометаллические (кластерное ядро состоит из атомов одного металла) и гетерометаллические (ядро состоит из атомов двух, трёх, четырёх и большего числа разл. металлов). В зависимости от числа атомов металла различают малые (2–12 атомов), средние (13–40 атомов), крупные (40–100 атомов) и гигантские кластеры (более 100 атомов, верхняя граница размыта). Примерами гигантских кластеров являются палладиевые кластеры [$\ce{Pd_{561}Phen_{60}(CH_3COO)_{180}}$] (где $\ce{Phen} – 1,10$-фенантролин) и полиоксомолибдатные кластеры состава [$\ce{Mo_{132}O_{372}(RCOO)_30(H_2O)_{72}}$]$^{42–}$ (где $\ce{R}$ – углеводородный радикал). В зависимости от типа полиэдра, который образуют связанные атомы металла, различают треугольные ($М_3$), тетраэдрические ($М_4$), квадратные ($М_4$), октаэдрические ($М_6$), тригонально-призматические ($М_6$), икосаэдрические ($М_{12}$) и др. кластерные структуры.
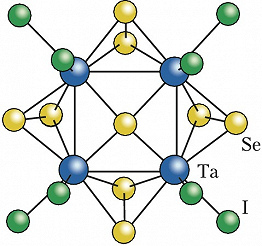
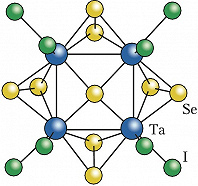
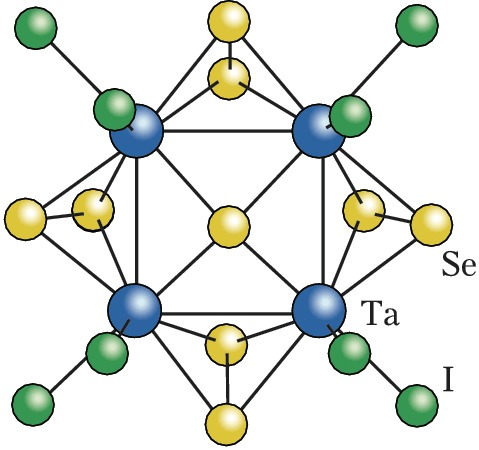
Лигандами в К. с. чаще всего являются атомы галогенов – галогенидные К. с., напр. $\ce{Mo6Cl12}$, халькогенов – халькогенидные К. с., напр. $\ce{Re6Te15}$, кислорода – оксидные К. с., напр. $\ce{Rb9O2}$, молекулы монооксида углерода – карбонильные К. с., напр. [$\ce{Rh4(CO)_{12}}$], а также органич. и элементоорганич. группировки (фосфины, олефины, циклопентадиенилы и др.). Примером К. с. со смешанными лигандами является кластер [$\ce{Ta4Se9I8}$] (формула). К К. с. относят не содержащие лигандов полианионы и поликатионы металлов (напр., $\ce{Bi4^2^-},$ $\ce{Ge9^4-},$ $\ce{Sn9^4-},$ $\ce{Sb7^3-},$ $\ce{Bi9^5+}$) – т. н. ионы Цинтля, а также не содержащие атомов металлов полиэдрич. гидриды бора, напр. [$\ce{B_{12}H_{12}}$]$^{2–}$, и карбораны, напр. $\ce{C_2B_{10}H_{12}}$.
Физич. свойства К. с. являются типичными для комплексных соединений: мн. К. с. представляют собой окрашенные кристаллич. вещества; незаряженные молекулярные К. с. с органич. лигандами умеренно растворимы в органич. растворителях, некоторые К. с. с ацидолигандами хорошо растворимы в воде или кислотах. Большинство К. с. диамагнитно.
К. с. участвуют в химич. реакциях двух типов – затрагивающих и не затрагивающих ядро из атомов металла. Напр., некоторые К. с. вступают в обратимые реакции многоэлектронного окисления-восстановления без изменения числа атомов металла в кластерном ядре. Известны окислительно-восстановит. реакции, в результате которых получаются К. с. с бо́льшим или меньшим числом атомов металла. Превращения лигандов в К. с. могут происходить так же, как в моноядерных комплексах. Однако часто К. с. вступают в необычные реакции с участием лигандов, т. к. присутствие нескольких атомов металла обеспечивает дополнит. возможности для взаимодействия металл – лиганд. Внутри ядра из атомов металла могут размещаться отд. атомы или группы атомов (напр., др. металлов, водорода, углерода, азота), находящихся в координационном окружении и не встречающихся в обычных комплексных соединениях.
К. с. могут сочетать преимущества гомогенных и гетерогенных катализаторов в реакциях гидрирования и окисления. Осн. примеры катализа К. с. обнаружены в природе: азот превращается в аммиак на кластере $\ce{Fe-Mo-S}$ нитрогеназы; монооксид углерода окисляется до диоксида углерода при участии ферментов, содержащих кластеры Fe2 или FeNi; в процессах переноса электронов важную роль играют ферредоксины, содержащие кластеры $\ce{Fe2S2}$, $\ce{Fe3S4}$ и $\ce{Fe4S4}$. К. с., такие как $\ce{PbMo6S8}$ (фазы Шеврёля), являются сверхпроводящими материалами с высокими критическими магнитными полями.