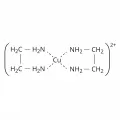
Комплексные соединения
Ко́мплексные соедине́ния (координационные соединения), химические соединения, в которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним (координированные) один или несколько ионов и/или молекул. Координированные частицы называются лигандами, число донорных атомов в них, координированных центральным атомом, – его координационным числом. Центральный атом связывает лиганды как за счёт электростатического, так и за счёт донорно-акцепторного взаимодействия. Координационное число и степень окисления являются важнейшими характеристиками атома-комплексообразователя.
Центральный атом и координированные лиганды образуют внутреннюю координационную сферу комплексного соединения; при написании формулы комплексного соединения её обычно заключают в квадратные скобки. Внутри скобок запись производится в следующей последовательности: химический символ центрального атома, символы анионных, затем нейтральных лигандов с указанием их числа. Если внутренняя сфера несёт заряд, то его компенсируют противоионы, образующие внешнюю сферу. Внешнесферными могут быть и катионы, например K+ в K4[Fe(CN)6], и анионы, например SO42− в [Сu(NH3)4]SO4. Кроме противоионов, во внешней сфере могут находиться нейтральные молекулы. Примерами комплексных соединений, состоящих только из центрального атома и лигандов, могут служить Ti(CO)7, Cr(CO)6 и другие карбонилы металлов.
Названия комплексного соединения строятся в соответствии с номенклатурными правилами ИЮПАК, начиная с лигандов и учитывая их заряд; например, [PtCl2(NH3)2] – дихлородиамминплатина(II), [Co(NH3)6](NO3)3 – нитрат гексаамминкобальта(III), Na2[PdCl4] – тетрахлоропалладат(II) натрия.
Историческая справка
Среди ранних, научно документированных, исследований комплексных соединений можно выделить получение [Cu(NH3)4]Cl2 в 1597 г. А. Либавием и KFe[Fe(CN)6] в 1704 г. немецким ремесленником Г. Дисбахом, однако в соответствии с существующими на тот период представлениями эти вещества относили к двойным солям.  Портрет Андреаса Либавия.Началом систематического изучения комплексных соединений обычно считают открытие французского химика Б. Тассера, описавшего в 1798 г. появление коричневой окраски в аммиачных растворах хлорида кобальта при образовании хлорида гексаамминкобальта(III) [Co(NH3)6]Cl3. Важной особенностью этого исследования было понимание того, что образующееся соединение является продуктом сочетания способных к самостоятельному существованию валентно-насыщенных, весьма устойчивых «простых» соединений и что для водных растворов образующегося «сложного», или комплексного (от лат. complexus – сочетание), соединения характерны свойства, отличные от свойств составляющих его простых соединений.
Портрет Андреаса Либавия.Началом систематического изучения комплексных соединений обычно считают открытие французского химика Б. Тассера, описавшего в 1798 г. появление коричневой окраски в аммиачных растворах хлорида кобальта при образовании хлорида гексаамминкобальта(III) [Co(NH3)6]Cl3. Важной особенностью этого исследования было понимание того, что образующееся соединение является продуктом сочетания способных к самостоятельному существованию валентно-насыщенных, весьма устойчивых «простых» соединений и что для водных растворов образующегося «сложного», или комплексного (от лат. complexus – сочетание), соединения характерны свойства, отличные от свойств составляющих его простых соединений.
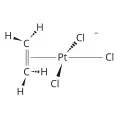 Структурная формула соли Цейзе.В 19 в. было синтезировано большое число разнообразных комплексных соединений; среди экспериментальных исследований можно выделить работы датских химиков В. Цейзе, получившего комплексное соединение платины с органическими лигандами K[PtCl3(C2H4)] (соль Цейзе, 1827), и С. Йёргенсена (синтезировал комплексные соединения кобальта, хрома, родия, платины). В этот же период Т. Грэм, К. К. Клаус и другие учёные делают попытки объяснить существование и структуру комплексных соединений. Из ранних теорий наиболее широко известна цепная теория шведского химика К. Бломстранда, развитая С. Йёргенсеном (теория Бломстранда – Йёргенсена, 1869), позволившая объяснить строение некоторых классов комплексных соединений (в частности, аммиакатов). Обобщённое представление опространственном строении комплексных соединений дала координационная теория, предложенная А. Вернером в 1893 г. (работа удостоена в 1913 Нобелевской премии).
Структурная формула соли Цейзе.В 19 в. было синтезировано большое число разнообразных комплексных соединений; среди экспериментальных исследований можно выделить работы датских химиков В. Цейзе, получившего комплексное соединение платины с органическими лигандами K[PtCl3(C2H4)] (соль Цейзе, 1827), и С. Йёргенсена (синтезировал комплексные соединения кобальта, хрома, родия, платины). В этот же период Т. Грэм, К. К. Клаус и другие учёные делают попытки объяснить существование и структуру комплексных соединений. Из ранних теорий наиболее широко известна цепная теория шведского химика К. Бломстранда, развитая С. Йёргенсеном (теория Бломстранда – Йёргенсена, 1869), позволившая объяснить строение некоторых классов комплексных соединений (в частности, аммиакатов). Обобщённое представление опространственном строении комплексных соединений дала координационная теория, предложенная А. Вернером в 1893 г. (работа удостоена в 1913 Нобелевской премии).  Альфред Вернер. Архив Нобелевского фонда.Координационная теория опровергала общепринятые для объяснения строения неорганических соединений представления о постоянной и направленной валентности. А. Вернер ввёл важные для целого исторического периода понятия «главной» и «побочной» валентности, координации, координационного числа, геометрии комплексного соединения, создал основы классификации комплексных соединений; вопрос о природе главной и побочной валентности в координационной теории не рассматривался. Разрешение вопроса о природе координационной связи стало возможным после создания электронной теории валентности (Г. Льюис, 1916). Основная заслуга в использовании этой теории для объяснения природы координационной связи принадлежит английскому химику Н. Сиджвику. Согласно концепции
Альфред Вернер. Архив Нобелевского фонда.Координационная теория опровергала общепринятые для объяснения строения неорганических соединений представления о постоянной и направленной валентности. А. Вернер ввёл важные для целого исторического периода понятия «главной» и «побочной» валентности, координации, координационного числа, геометрии комплексного соединения, создал основы классификации комплексных соединений; вопрос о природе главной и побочной валентности в координационной теории не рассматривался. Разрешение вопроса о природе координационной связи стало возможным после создания электронной теории валентности (Г. Льюис, 1916). Основная заслуга в использовании этой теории для объяснения природы координационной связи принадлежит английскому химику Н. Сиджвику. Согласно концепции
 Лев Чугаев.Сиджвика (1923), главные валентности были интерпретированы как результат переноса электрона, побочные – как результат обобществления электронных пар. Развитие современных представлений о природе координационной связи связано с использованием квантовохимических подходов – теории кристаллического поля, метода валентных связей, метода молекулярных орбиталей, теории поля лигандов; основной вклад в распространение на комплексные соединения метода валентных связей принадлежит Л. Полингу, теории кристаллического поля –
Лев Чугаев.Сиджвика (1923), главные валентности были интерпретированы как результат переноса электрона, побочные – как результат обобществления электронных пар. Развитие современных представлений о природе координационной связи связано с использованием квантовохимических подходов – теории кристаллического поля, метода валентных связей, метода молекулярных орбиталей, теории поля лигандов; основной вклад в распространение на комплексные соединения метода валентных связей принадлежит Л. Полингу, теории кристаллического поля –
 Илья Черняев. 1952.американскому химику Л. Оргелу. Развитию химии комплексных соединений способствовали исследования американских учёных Дж. Бейлара, Р. Пирсона, Г. Грея, отечественных химиков И. И. Черняева, Л. А. Чугаева, А. А. Гринберга, К. Б. Яцимирского и др.
Илья Черняев. 1952.американскому химику Л. Оргелу. Развитию химии комплексных соединений способствовали исследования американских учёных Дж. Бейлара, Р. Пирсона, Г. Грея, отечественных химиков И. И. Черняева, Л. А. Чугаева, А. А. Гринберга, К. Б. Яцимирского и др.
В течение длительного периода химия комплексных соединений – координационная химия – считалась одним из разделов неорганической химии, поскольку большинство известных комплексных соединений содержало в качестве лигандов неорганические молекулы или ионы (аммиак, воду, цианогруппу и т. п.).
Выделение координационной химии в самостоятельный, интенсивно развивающийся раздел химической науки связано не только с многочисленностью комплексных соединений (комплексные соединения по распространённости – вторые после органических соединений, известны практически для всех элементов-металлов и для некоторых неметаллов, содержат как неорганические, так и органические лиганды самых разнообразных типов), стремительным ростом количества изучаемых объектов и открытием новых классов комплексных соединений (металлоорганических соединений π-комплексного типа, природных комплексных соединений и их синтетических аналогов и пр.), но и с разработкой теоретических представлений, позволяющих рассматривать разнообразные классы комплексных соединений на единой основе. Междисциплинарное положение координационной химии обусловливает необходимость использования для её развития методов неорганической, физической, органической, аналитической, структурной химии. Изучение химических и физико-химических свойств комплексных соединений способствует установлению закономерностей, представляющих интерес для органической, биологической химии, катализа, электрохимии, фотохимии, химической технологии, материаловедения, медицины и других смежных областей.
Классификация
Сложность классификации комплексных соединений обусловлена их многообразием. Наиболее общие принципы классификации комплексных соединений следующие:
1) по заряду: нейтральные, например [PtCl2(NH3)2]; катионные, например [Cr(NH3)6]Cl3; анионные, например ацидокомплексы (лигандами служат анионы кислот – ацидогруппы) – K4[Fe(CN)6], K[AuCl4] и другие; катионно-анионные, например [Cr(NH3)6][Fe(CN)6]; молекулярные, например Ni(CO)4;
2) по типу лигандов: простые, содержащие монодентатные лиганды, например [Cu(NH3)4]Cl2; хелатные – с присоединёнными к одному центральному атому через два или более соединительных, координирующих атома хелатными лигандами, например [Cu(en)2]Cl2 (en – этилендиамин H2NCH2CH2NH2 имеет два координирующих атома азота); содержащие лиганды одного типа, например [Co(NH3)6]Cl3; содержащие различные лиганды, например [Co(NH3)4Cl2];
3) по количеству атомов элемента-комплексообразователя: моноядерные (все вышеприведённые примеры); полиядерные (или многоядерные), например [(en)2Cr(OH)2Cr(en)2]Br4; к полиядерным комплексным соединениям относятся также кластеры, металлоцены, комплексы с мостиковыми лигандами и некоторые другие соединения.
К комплексам с мостиковыми лигандами относятся гетерополисоединения – комплексные соединения анионного типа, содержащие во внутренней сфере в качестве лигандов анионы неорганических изополикислот (молибденовых, вольфрамовых и др.); изополианионы содержат мостиковые связи М−О−М, где М – атом-комплексообразователь (P, As, Si, Ge, Ti, Ce), например K3[PMo12O40], K8[Co2W12O42].
В отдельные группы выделяют комплексные соединения с одинаковыми лигандами: аквакомплексы (лигандами служат молекулы воды H2O), например [Co(H2O)6]Cl2; аммины (лиганды – молекулы аммиака NH3), например [Pt(NH3)4]Cl2, в эту же группу входят аммиакаты – комплексные соединения, содержащие молекулы аммиака не только во внутренней, но и во внешней сфере; гидроксокомплексы (лиганды – гидроксид-ионы OH−), например K2[Rb(OH)6]; гидридные комплексы (лиганды – гидрид-ионы Н−), например Na[AlH4], Li[BH4]; галогенаты (содержат атом галогена в качестве комплексообразователя и галогенидные лиганды); некоторые другие. Галогенаты, в свою очередь, подразделяются на анионгалогенаты, например Rb[Br(Br)2], NH4[ICl4] (соответственно изополигалогенат и гетерополигалогенат), и катионгалогенаты, например [BrF2][AsF6], [ICl2][SbCl6].
Строение
Химическая связь в комплексных соединениях – координационная связь – осуществляется либо за счёт размещения неподелённой электронной пары донорного атома лиганда на свободных (и доступных) электронных орбиталях центрального атома (акцептора), либо за счёт перехода собственных электронов металла-комплексообразователя на незаполненные орбитали лиганда. В последнем случае чаще всего это молекулярные разрыхляющие π-орбитали, поэтому такая связь называется π-донорной, или π-дативной. Наиболее наглядную качественную информацию об образовании координационной связи даёт метод валентных связей. Детальные теоретические представления о строении комплексных соединений отражены в методе молекулярных орбиталей, теории кристаллического поля и теории поля лигандов. В рамках этих подходов даются объяснения электронного и геометрического строения комплексных соединений, проводятся оценки энергии связей. В современных теориях строения комплексных соединений и природы координационной связи используются представления о кислотах и основаниях Льюиса, принцип Пирсона о мягких и жёстких кислотах и основаниях.
Центральным атомом в комплексных соединениях может быть как металл, так и неметалл. Прочность координационной связи металл – лиганд тем выше, чем выше заряд иона-комплексообразователя и чем меньше его радиус. Существенную роль играет электронная структура центрального атома. Ионы с электронной конфигурацией инертного газа обладают наименьшей склонностью к комплексообразованию. Более сильными комплексообразователями являются ионы 3d-элементов, имеющие как незавершённые, так и завершённые электронные оболочки. Из-за большего радиуса и размытости электронных орбиталей ионы 4d-, 5d-, 4f-элементов и особенно 5f-элементов образуют менее прочные связи. Эти общие закономерности обусловлены характером заполненности электронной оболочки металла, а также стерическими требованиями – оптимальным соотношением между размерами центрального атома и лигандов. В качестве атома-комплексообразователя чаще всего выступают атомы переходных металлов (Ti, V, Cr, Mn, Fe, Co, Ni, Сu, Zn, Zr, Nb, Mo, Ru, Rh, Pd, Ag, Cd, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg, редкоземельных элементов, актиноидов). Из неметаллов в качестве центральных атомов чаще всего выступают атомы B, P, Si.
Лигандами в комплексных соединениях могут быть анионы неорганических и органических кислот (F−, Cl−, Br−, I−, CN−, NO2− , SO42− , PO43−, C2O42− и др.), различные нейтральные молекулы, ионы и свободные радикалы, содержащие атомы O, N, P, S, Se, C. Активность лиганда зависит от природы донорного атома: жёсткие катионы (щелочных, щёлочноземельных металлов, лантаноидов) предпочтительно связываются донорным атомом кислорода, более мягкие (переходных d-элементов) – донорными атомами N, S и др. Лиганд с несколькими донорными атомами (например, этилендиаминтетрауксусная кислота) способен образовывать хелатные циклы, обладающие высокой устойчивостью. Существенную роль при образовании комплексных соединений играет строение (в том числе гибкость) молекулы лиганда. По своей способности внедряться в электронные оболочки центрального атома, приводящей к изменению её строения, лиганды условно подразделяют на лиганды сильного и слабого поля.
При образовании комплексного соединения металл-комплексообразователь предоставляет свои валентные электронные орбитали (как заполненные, так и свободные) для размещения на них донорных электронных пар лигандов. Число и направленность заполненных общими электронами орбиталей определяют пространственное строение – стереохимию – комплексных соединений. Так, sp-комбинация молекулярных орбиталей соответствует линейному строению комплексных соединений, например [Ag(NH3)2]+; sp2 – плоскому треугольному, например (AlF3); sp3 – тетраэдрическому, например (Zn(NH3)4]2+; sp3d – тригонально-бипирамидальному, например (NbF5); dsp2 – плоскому квадратному, например [Ni(CN)4]2−; d2sp3 или sp3d2 – октаэдрическому, например [Co(NH3)6]3+, и т. д. Пространственное расположение лигандов вокруг центрального атома характеризуется координационным полиэдром.
Изомерия
Многообразие комплексных соединений обусловлено образованием изомеров, одинаковых по составу, но отличающихся расположением лигандов вокруг центрального атома.
Гидратная (сольватная) изомерия
Гидратная (сольватная) изомерия обусловлена различным распределением молекул воды и анионных лигандов между внутренней и внешней сферами комплексных соединений. Например, соединение CrCl3 · 6H2O существует по крайней мере в трёх изомерных формах: [Cr(H2O)6]Cl3 – трихлорид гексааквахрома(III) фиолетового цвета, [CrCl(H2O)5]Cl2 · H2O – моногидрат дихлорид пентааквахлорохрома(III) сине-зелёного цвета и [CrCl2(H2O)4]Cl · 2H2O – дигидрат хлорид тетрааквадихлорохрома(III) зелёного цвета. Эти изомеры по-разному реагируют с раствором AgNO3, поскольку в осадок (AgCl) переходит только хлор, содержащийся во внешней сфере.
Ионизационная изомерия
Ионизационная изомерия характеризуется различным распределением ионов между внешней и внутренней сферами комплексных соединений. При диссоциации в растворе такие изомеры образуют разные ионы. Например, для соединения CoBrSO4 · 5NH3 известны два изомера: [CoBr(NH3)5]SO4 – красно-фиолетового цвета и [CoSO4(NH3)5]Br – красного цвета.
Координационная изомерия
Координационная изомерия заключается в различном распределении лигандов во внутренних координационных сферах. Например, изомеры [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6] по-разному взаимодействуют с AgNO3: [Co(NH3)6][Cr(CN)6] образует осадок состава Ag3[Cr(CN)6], [Cr(NH3)6][Co(CN)6] приводит к осаждению соединения Ag3[Co(CN)6].
Геометрическая изомерия
Геометрическая изомерия (цис-, транс-изомерия) обусловлена различным пространственным расположением лигандов вокруг центрального атома. Так, комплекс [PtCl2(NH3)2] существует в виде цис-изомера (формула I) и транс-изомера (формула II), отличающихся друг от друга рядом свойств.
![Геометрическая изомерия комплекса [PtCl₂(NH₃)₂] (цис-, транс-изомеры) Геометрическая изомерия комплекса [PtCl₂(NH₃)₂] (цис-, транс-изомеры)](https://i.bigenc.ru/resizer/resize?sign=cRNhHLuLdbUWTtYpukCAKg&filename=vault/91d16b2790d2e46ff1e00a07c18e22a8.webp&width=120) Геометрическая изомерия комплекса [PtCl₂(NH₃)₂] (цис-, транс-изомеры).Оптическая изомерия
Геометрическая изомерия комплекса [PtCl₂(NH₃)₂] (цис-, транс-изомеры).Оптическая изомерия
Оптическая изомерия характеризуется способностью вращать плоскость поляризации плоскополяризованного света. Два изомера – правый и левый – отличаются друг от друга направлением вращения. Эти изомеры – зеркальные изображения друг друга – не могут быть совмещены в пространстве. Из двух геометрических изомеров бис-(этилендиамин)бромохлороникеля(II) [NiClBr(en)2] только цис-изомер может существовать в виде двух оптических изомеров – энантиомеров:
![Два оптических изомера [NiClBr(en)₂] Два оптических изомера [NiClBr(en)₂]](https://i.bigenc.ru/resizer/resize?sign=lHXXWr_Omu87UgaqpNa99w&filename=vault/7767c1b5ca947c41a6d3eba2a8710388.webp&width=120) Два оптических изомера [NiClBr(en)₂].Структурными (конформационными) изомерами называют такие координационные изомеры, в которых происходит изменение симметрии (пространственного строения) координационной сферы.
Два оптических изомера [NiClBr(en)₂].Структурными (конформационными) изомерами называют такие координационные изомеры, в которых происходит изменение симметрии (пространственного строения) координационной сферы.
Свойства
Различают термодинамическую стабильность комплексных соединений – меру возможности образования комплексных соединений или его превращения в другое соединение в равновесных условиях, и кинетическую, описывающую скорость реакций комплексов, ведущих к достижению равновесия. Термодинамическая стабильность комплексных соединений характеризуется терминами «устойчивый», «неустойчивый», кинетическая – «лабильный» и «инертный». Если при комнатной температуре реакция комплекса протекает за время смешения реагентов (около 1 мин), комплексные соединения относят к лабильным; если реакция протекает с измеримой скоростью и половина времени жизни комплекса более 2 мин, такие комплексные соединения относят к инертным. Например, константа скорости изотопного обмена молекул воды во внутренней координационной сфере для инертного комплекса [Ni(H2O)6]2+ равна 3,3 104 с−1, для лабильного [Сr(Н2О)6]3+ – 5 · 10−7 c−1.
Устойчивость комплексных соединений определяется природой центрального атома и лиганда, а также стерическими факторами. В соответствии с принципом жёстких и мягких кислот и оснований все центральные атомы условно разделяют на жёсткие и мягкие кислоты Льюиса. Жёсткие кислоты Льюиса имеют малый атомный или ионный радиус, высокую положительную степень окисления, предпочтительно взаимодействуют с неполяризующимися жёсткими основаниями, такими как F−, OH−, NR2− (R – органический радикал). К жёстким кислотам Льюиса относятся ионы элементов в высших степенях окисления с электронной конфигурацией d0 или d10. Мягкие кислоты Льюиса имеют большой атомный или ионный радиус и низкую степень окисления, более эффективно взаимодействуют с легко поляризующимися мягкими лигандами, такими как SR2, PR3, I−, олефины. Мягкие кислоты Льюиса имеют электроны на d-орбиталях, способные к образованию π-связей в результате перекрывания с вакантными d-орбиталями мягких лигандов. Эти же центральные ионы образуют комплексные соединения с олефинами (типа соли Цейзе). Поскольку реакции комплексообразования подразумевают взаимодействие кислот и оснований Льюиса, с увеличением оснóвных свойств лигандов устойчивость комплексов повышается. Лиганды с большей основностью при введении в раствор полностью замещают во внутренней сфере лиганды с меньшей основностью.
Количественной характеристикой устойчивости комплексных соединений служит его константа устойчивости , где , , – равновесные концентрации комплекса, комплексообразователя и лиганда соответственно. Для экспериментального определения константы устойчивости применяют физико-химические методы, позволяющие рассчитать равновесные концентрации (рН-метрическое титрование, кондуктометрию, спектрофотометрию, ЯМР-спектроскопию, полярографию, вольтамперометрию и др.).
Свободная энергия Гиббса реакции образования комплекса связана с , энтальпийным вкладом () и энтропийным вкладом () соотношением: , где – абсолютная температура, – газовая постоянная. В реакциях комплексообразования энтальпийный вклад обусловлен разностью в суммарной энергии связей исходных частиц и образующегося комплексного соединения; обычно величины невелики. Энтропийный вклад связан с изменением числа частиц в реакции. Потеря подвижности иона металла и лигандов при соединении их в комплексных соединениях обычно компенсируется за счёт высвобождения большого количества молекул растворителя (воды) из сольватных (гидратных) оболочек центрального атома и лигандов.
Комплексные соединения участвуют в реакциях присоединения, замещения или элиминирования лиганда, реакциях изомеризации координационного полиэдра, реакциях связанного лиганда (например, диссоциация, изомеризация лиганда) и реакциях электронного переноса.
Методы синтеза
В молекуле комплексного соединения можно сочетать различные металлы и лиганды, что позволяет варьировать состав комплексного соединения, их строение и свойства. Используя соответствующую методику синтеза, можно получить комплексное соединение с практически любыми заданными свойствами и в любом агрегатном состоянии. Многочисленные методы синтеза комплексных соединений можно классифицировать по типам реакций, лежащих в их основе (реакции замещения, обмена, окислительно-восстановительные и т. д.). Выбор методики синтеза зависит от природы комплексного соединения (термодинамической устойчивости, кинетической инертности или лабильности) и в соответствии с этим основывается на термодинамических или на кинетических подходах. К группе методов, основанных на термодинамическом подходе, относятся реакции, направление которых определяется термодинамическими факторами: энергетической выгодностью образования продукта реакции по отношению к исходным соединениям (отрицательным изменением энергии Гиббса). В этих методах механизм реакций не играет существенной роли в процессе синтеза. В методах, основанных на кинетическом подходе, строение продукта генеалогически связано с исходными соединениями, синтез протекает в основном с использованием реакций замещения и важную роль играет их механизм. В этом случае образование продукта может быть энергетически выгодно, но возможно и получение метастабильных комплексных соединений, образование которых энергетически менее выгодно по сравнению с другими продуктами.
Специфическим методом получения комплексных соединений является темплатный синтез, когда сложные органические лиганды образуются в процессе взаимодействия иона металла с более простыми органическими соединениями. Ион металла – матрица, на которой закрепляются исходные лиганды, – способствует пространственной ориентации лигандов и тем самым определяет направление реакции их взаимодействия. При отсутствии ионов металла-комплексообразователя реакция не протекает или протекает с малым выходом. Темплатный синтез наиболее эффективен для получения макроциклических лигандов.
Области применения
Металлоорганические комплексные соединения – один из наиболее перспективных классов химических соединений, на основе которых могут быть созданы молекулярные материалы. Сочетание в одной молекуле ионов металлов и органических лигандов, возможность целенаправленного изменения состава и строения комплексных соединений открывают возможности для создания на их основе молекулярных материалов с широким диапазоном функциональных свойств – оптических, магнитных, электрических и т. д.
Комплексные соединения применяют для выделения и очистки платиновых металлов, золота, серебра, никеля, кобальта, меди, в процессах разделения редкоземельных элементов, щелочных металлов и в ряде других технологических процессов.
Комплексные соединения используют в химическом анализе для качественного обнаружения и количественного определения многих химических элементов. В живых организмах различные типы комплексных соединений представлены соединениями ионов металлов (Fe, Cu, Mg, Mn, Mo, Zn, Co) с белками (металлопротеиды), витаминами, коферментами, другими веществами, выполняющими специфические функции в обмене веществ. Природные комплексные соединения участвуют в процессах дыхания, фотосинтеза, биологического окисления, в ферментативных процессах.
Комплексные соединения используют в экстракционных и сорбционных процессах разделения и тонкой очистки редких, цветных и благородных металлов, в аналитической химии. Применяют в качестве селективных катализаторов различных процессов химической и микробиологической промышленности, для создания окислителей на основе фторидов, галогенов и благородных газов, в качестве источников H2 и O2 на основе гидридов и кислородсодержащих соединений, в медицине, в том числе в терапии различных видов опухолей, в качестве источника микроэлементов в животноводстве и сельском хозяйстве, для получения тонких покрытий на различных изделиях микроэлектроники для придания антикоррозионных свойств и механической прочности.