МЕТАСТАБИ́ЛЬНОЕ СОСТОЯ́НИЕ
-
Рубрика: Физика
-
-
Скопировать библиографическую ссылку:
МЕТАСТАБИ́ЛЬНОЕ СОСТОЯ́НИЕ. 1) М. с. термодинамической системы, термодинамически неравновесное состояние, устойчивое относительно малых возмущений. Со временем вещество, находящееся в М. с., переходит в состояние термодинамич. равновесия вследствие маловероятных больших спонтанных флуктуаций или под действием больших внешних возмущений. В отсутствие таких флуктуаций и возмущений М. с. может существовать длительное время, превосходящее на много порядков величины такие характерные времена, как время свободного пробега молекулы в газе, периоды колебаний кристаллич. решётки твёрдого тела, время диффузии молекул жидкости на расстояния порядка 0,1 нм. Кроме реакции на большие возмущения, М. с. подчиняются тем же термодинамич. законам, что и равновесные состояния. Многие М. с. связаны с существованием больших энергетич. барьеров или сил трения в процессе перехода в термодинамич. равновесие. При фазовых переходах 1-го рода это работа образования зародыша новой фазы – жидкости при конденсации пара и льда при замерзании жидкости. При этом М. с. являются переохлаждённый пар и переохлаждённая жидкость – состояния, сравнительно легко осуществимые в лаборатории и природе.
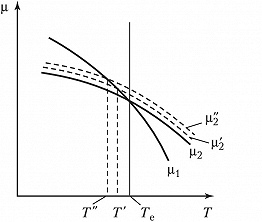
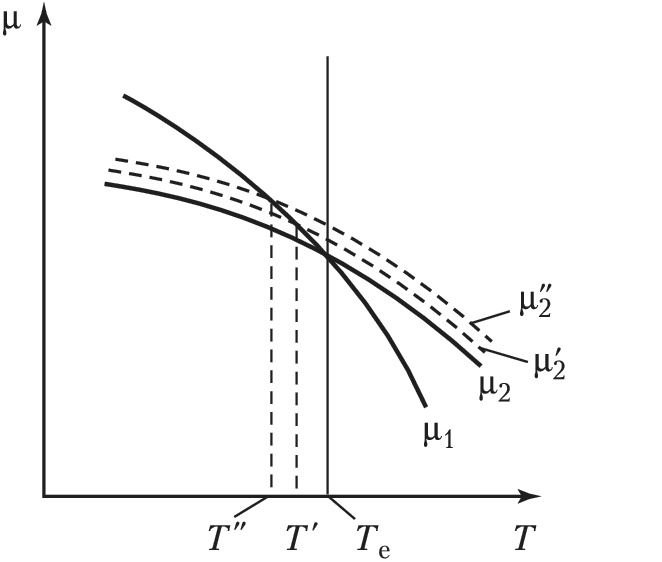
Условием термодинамич. равновесия фаз является минимум свободной энергии двухфазной системы, т. е. равенство химич. потенциалов фаз: $μ_1(T, p)=μ_2(T, p)$. На рис. такому равенству при заданном постоянном давлении p отвечает темп-ра $T_\text e$. Слева от сплошной вертикальной линии устойчива жидкость (фаза 2), справа – пар (фаза 1). Химич. потенциал микроскопич. капли больше, чем для капли макроскопич. (бесконечных) размеров, вследствие большой удельной поверхностной энергии малой капли (линия $μ'_2$ на рис.). Поэтому область устойчивости фазы 1 относительно такой капли расширяется до вертикальной линии $T'$. В процессе охлаждения однородной фазы 1 образование новой фазы начинается с капли миним. размеров – порядка 1 нм или менее. Химич. потенциал таких частиц (наночастиц) максимален (линия $μ''_2$ на рис.). Точке пересечения линий $μ''_2$ и $μ_1$ отвечает на рис. темп-ра $T''$. В интервале температур $T_\text e÷T''$ возможно существование М. с. фазы 1. В этом интервале каждой темп-ре $T'$ при неизменном давлении $p$ соответствует свой размер микроскопич. капли жидкости – зародыша фазы 2. Он образуется в качестве флуктуации. Чем меньше разность $T_\text e-T'$, тем больше размер зародыша (больше флуктуация) и больше время существования М. с. фазы 1.
К М. с. относятся и «смесевые» системы, такие как горючее (уголь, керосин и т. п.) и окислитель (кислород). Без зажигания (сильное внешнее возмущение) они могут соседствовать сколь угодно долго, хотя в состоянии термодинамич. равновесия – это продукты сгорания. Др. примеры М. с. – аморфные тела, поликристаллы, закалённые сплавы, мн. минералы. С существованием М. с. связаны явления гистерезиса.
2) М. с. квантовой системы, возбуждённое состояние ядер, атомов, ионов и молекул, имеющее аномально большое время жизни $τ$ (т. е. малую вероятность спонтанного распада). Низкая вероятность распада, как правило, связана с тем, что радиационные переходы из М. с. в состояние с меньшей энергией запрещены отбора правилами. Если для атома в возбуждённом состоянии, из которого разрешены радиационные переходы, характерное значение $τ=$ 10–8 с, то для атома в М. с. значение $τ$ может быть на много порядков больше (напр., для атома водорода на верхнем энергетич. уровне сверхтонкой структуры $τ=$ 107 лет). Аналогично при ядерных радиационных переходах характерное время жизни возбуждённого состояния $τ=$ 10–15–10–9 с, в то время как для М. с. радионуклидов значение $τ$ может достигать миллионов лет.
М. с. атомов и ионов играют важную роль в спектроскопич. диагностике плазмы, позволяя измерять её плотность по относит. интенсивностям линий спектра. М. с. ядер открывают возможность создания долгоживущих радионуклидов, широко используемых в медицине и технике. С М. с. молекул связано также явление люминесценции.