ПОТЕНЦИОМЕ́ТРИ́Я
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
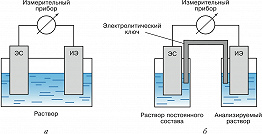
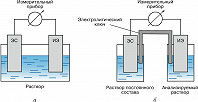
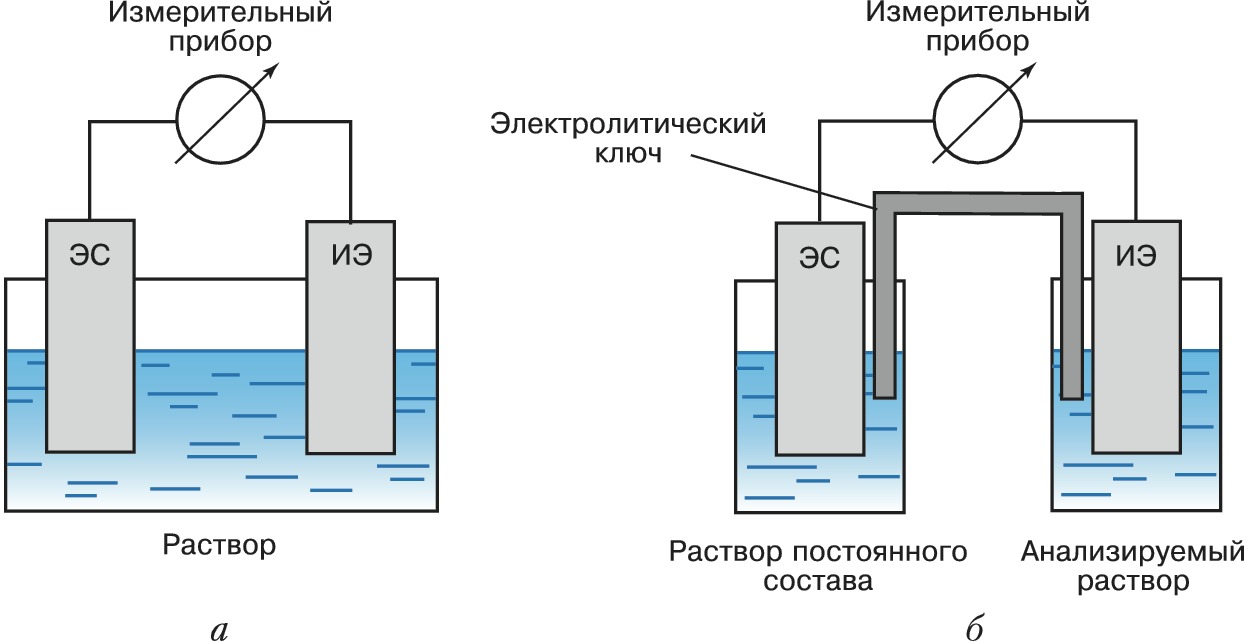
ПОТЕНЦИОМЕ́ТРИ́Я, электрохимич. метод физико-химич. анализа электролитного состава растворов, а также термодинамич. исследований, основанный на измерении электродвижущих сил (эдс, $E$), возникающих в гальванич. элементах. История метода восходит к работам Л. Гальвани, М. Фарадея, англ. физика Дж. Даниеля. В 1875 Дж. Гиббс показал, что $E$ определяется изменением свободной энергии $ΔG$ (функции Гиббса) химич. реакции, протекающей в гальванич. элементе, и числом электронов $n$, участвующих в реакции: $E=–ΔG/nF$ ($F$ – постоянная Фарадея). Аналитич. применение П. основано на представлениях В. Нернста (1889) об эдс как разности потенциалов электродов, из которых составлен гальванич. элемент: индикаторного электрода (ИЭ) и электрода сравнения (ЭС). Для термодинамич. исследований (измерений величин функции Гиббса, активностей электролитов и др.) применяют гальванич. элементы без жидкостного соединения, в которых оба электрода помещены в один и тот же раствор (рис. 1, а). Ионометрия состоит в получении аналитич. информации о концентрации некоего отд. иона по потенциалу соответствующего индикаторного электрода при постоянном потенциале электрода сравнения. Для этого электрод сравнения помещают в отд. сосуд, заполненный раствором постоянного состава и соединённый с анализируемым образцом при помощи электролитич. ключа, составляя гальванич. элемент с жидкостным соединением (рис. 1, б). В качестве электрода сравнения чаще других используют хлорсеребряный электрод в насыщенном растворе $\ce{KCl}$. Область контакта ключа и исследуемого раствора называют жидкостным соединением, в ней возникает т. н. диффузионный потенциал, который полностью элиминировать невозможно, но удаётся минимизировать, заполняя ключ электролитом, ионы которого имеют одинаковые коэффициенты диффузии.
Различают классич. электроды (1-го, 2-го, 3-го рода, окислительно-восстановительные) и мембранные ионоселективные электроды. Электроды 1-го рода состоят из активных (неинертных) металлов (напр., цинка, меди, серебра), погружённых в растворы их солей. На границе раздела такого электрода с раствором происходит окислительно-восстановит. реакция и возникает электродный потенциал, величина которого φ связана с активностью ($a_I$) катиона металла в растворе уравнением Нернста: $φ_I=φ_I^0+(RT/z_IF)\ln a_I$ ($φ^0$ – стандартное значение потенциала, $R$ – газовая постоянная, $T$ – абсолютная темп-ра). Напр., на медном электроде в растворе сульфата меди происходит реакция $\ce{Cu^{2+} + 2e<=>Cu}$, а его потенциал может быть выражен как $φ_{Cu}=φ_0^{Cu}+(RT/2F)\ln a_{Cu}$. Аналогичным образом описываются потенциалы газовых электродов, важнейший из которых – водородный газовый электрод: платиновая пластинка в растворе, через который продувают струю водорода. Водород адсорбируется на платине и каталитически разлагается с образованием атомов водорода, которые переходят в раствор в виде ионов $\ce{H+}$, оставляя на платине электроны: $\ce{H2(Pt)<=>2H+ +2e}$. Потенциал водородного газового электрода определяется активностью ионов $\ce{H+}$ в растворе (т. е. величиной $\ce{pH}$) и парциальным давлением водорода ($p\ce{_{H_2}}$) над раствором: $φ_H=φ^0_H+(RT/F)\ln a_H – (RT/2F)\ln p_{\ce{H2}}$ . Стандартный потенциал водородного газового электрода $φ^0$ принимается равным нулю при всех темп-рах, а величины потенциалов всех др. электродов определены по отношению к потенциалу водородного газового электрода. В электродах 2-го рода на металл наносят (химически или электролитически) осадок малорастворимой соли этого металла, потенциал такого электрода становится функцией активности соответствующего аниона. Напр., хлорсеребряный электрод – это серебряный стержень, покрытый слоем хлорида серебра, для его потенциала можно получить выражение $φ_{Cl}=φ^0_{Cl}-(RT/F)\ln a_{Cl}$. В электродах 3-го рода на металлич. стержень нанесены два осадка (напр., хлориды серебра и свинца на серебряном стержне). Окислительно-восстановит. электроды состоят из инертного металла (золота, платины) или углеродного материала, погружённых в раствор, содержащий окислительно-восстановит. систему (напр., соли железа в разных степенях окисления). Потенциал такого электрода определяется отношением активностей восстановленной и окисленной форм в растворе; в приведённом примере $φ=φ^0-(RT/F)\ln(a_{Fe^{II}}/a_{Fe^{III}})$. Электроды 1-го, 2-го и 3-го рода можно применять для определения концентраций соответствующих ионов (в приведённых примерах ионов $\ce{Cu^{2+}}$, $\ce{Cl^{–}}$, $\ce{Pb^{2+}}$), но на их потенциалы влияет наличие окислительно-восстановит. систем и ионов, образующих малорастворимые соединения с металлами электродов. Окислительно-восстановит. электроды применяют, в частности, для определения химич. и биологич. потребности в кислороде, активного хлора.
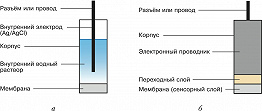
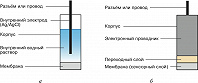
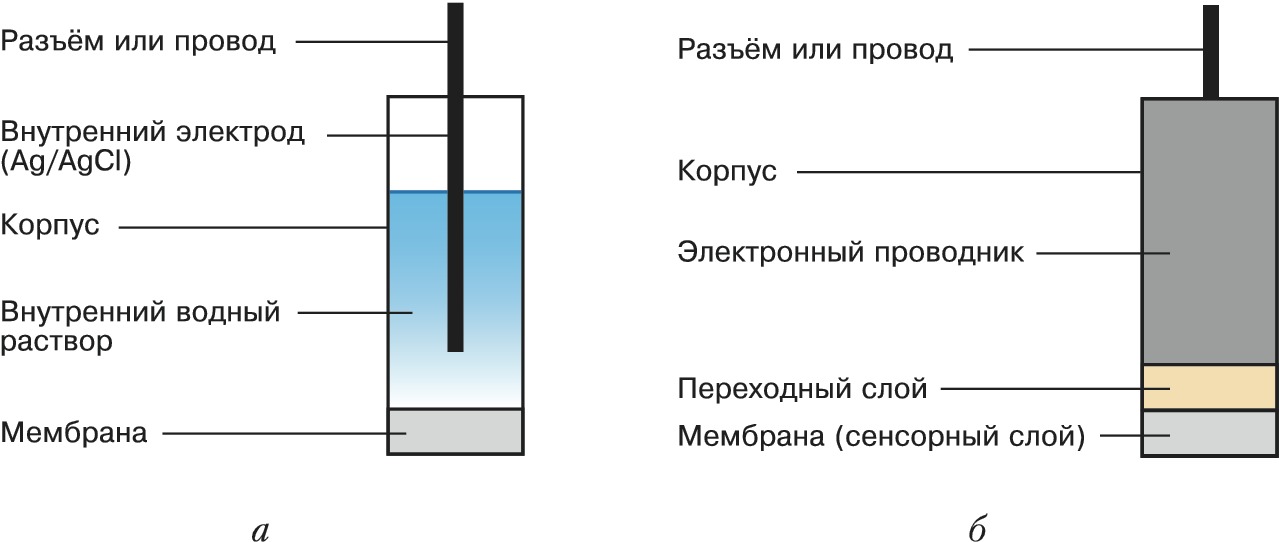
Ионоселективные электроды (ИСЭ) содержат мембрану (сенсорный слой), различают ИСЭ с внутр. раствором (рис. 2,а) и твердоконтактные (рис. 2,б). Для ИСЭ характерна избирательная (селективная) зависимость потенциала от активности определяемого иона в среде, содержащей также другие (т. н. мешающие) ионы. В 1937 Б. П. Никольский теоретически показал, что эта зависимость удовлетворительно описывается уравнением: $$φ_I=φ_I^0+(RT/zF)\ln \left( a_I+\sum_J K_{IJ}a_J\right),$$ где $K_{IJ}$ – коэф. селективности ИСЭ к ионам $I^Z$ в присутствии ионов $J^Z$. Для ионов с разными величинами заряда ($I^{Z_I}$ , $J^{Z_J}$) применяют похожее уравнение: $$φ_I=φ_I^0+(RT/z_I F)\ln \left( a_I+\sum_J K_{IJ}a_J^{Z_I/Z_J}\right),$$ которое, однако, не имеет теоретич. обоснования. Чем $K_{IJ}$ меньше, тем меньшее влияние оказывают мешающие ионы на потенциал электрода. Селективность определяется химич. свойствами мембраны, которая может быть стеклянной, кристаллич. или полимерной. Стеклянные ИСЭ – непревзойдённые датчики pH, с их помощью можно также определять содержание ионов натрия, исследовать расплавы солей. Кристаллич. ИСЭ применяют для определения анионов фтора, галогенидов, катионов тяжёлых металлов. Электроды с полимерными мембранами, содержащими ионофоры (вещества, избирательно связывающие те или иные ионы), пригодны для определения десятков самых разл. аналитов. Важнейшими аналитами, доступными для определения с помощью ИСЭ на основе ионофоров, являются ионы $\ce{K+}$, $\ce{Na+}$, $\ce{Ca^{2+}}$, $\ce{NH_4^+}$, $\ce{NO_3^-}$, $\ce{CO_3^{2–}}$, а важнейшими областями применения – клинич. анализ (кровь, моча, слюна), агрохимия, контроль состава продуктов питания, экологич. мониторинг, а также произ-ва, связанные с применением тяжёлых металлов. На основе стеклянных и полимерных ИСЭ создаются также устройства для анализа газовых смесей, ферментные электроды для биохимич. исследований.
Измерит. приборы, применяемые в П., представляют собой прецизионные вольтметры с входным импедансом не менее 1012 Ом, что достигается использованием операционных усилителей. Диапазон концентраций, определяемых с помощью ИСЭ, обычно 10–6–10–1 моль/дм3. Достоинство прямой П. с ИСЭ, основанной на уравнениях Нернста и Никольского, – в постоянстве относит. погрешности во всём этом диапазоне. Однако сама по себе эта погрешность составляет 1–10%. Для повышения точности анализа применяют потенциометрич. титрование (т. е. титрование с потенциометрич. индикацией), разл. методы добавок. Исторически П. развивалась как сугубо равновесный метод, но начиная с 1999 для расширения диапазона чувствительности ИСЭ до 10–9–10–12 моль/дм3 применяют гальваностатическую поляризацию электродов.