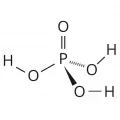
Ортофосфорная кислота
Ортофо́сфорная кислота́ (фосфорная кислота), H3PO4, наиболее устойчивая в ряду кислородсодержащих кислот фосфора(V).
Свойства
Ортофосфорная кислота – бесцветные гигроскопичные кристаллы, расплывающиеся на воздухе; плотность 1880 кг/м3; tпл 42,35 °С; tкип 158 °С. При нагревании до 150 °C H3PO4 теряет воду, переходя в дифосфорную кислоту H4P2O7, при 300 °C – в метафосфорную кислоту (HPO3)x. При снижении температуры (например, до 15 °C) расплав H3PO4 часто образует переохлаждённую жидкость. Ортофосфорная кислота неограниченно растворима в воде, из высококонцентрированных растворов кристаллизуется в виде гемигидрата (полугидрата) H3PO4·0,5H2O. В водных растворах H3PO4 – сильная трёхосновная кислота (K1 = 7,24·10–3; K2 = 6,17·10–8; K3 = 4,57·10–13). Образует три ряда солей: M3PO4, M2HPO4, MH2PO4 (ортофосфаты, гидроортофосфаты и дигидроортофосфаты) и эфиры, например триалкилфосфаты (RO)3PO (см. в статье Фосфаты).
Получение
Ортофосфорную кислоту получают по реакции природных фосфатов с концентрированной серной кислотой: .
Применение
Применяется как полупродукт в производстве удобрений, фармацевтических препаратов, кормовых концентратов, катализатор в органическом синтезе, антипирен, компонент антикоррозионных покрытий на металлах, в производстве сахара (осветление), как добавка к безалкогольным напиткам и др.