Лиганды
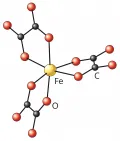
Лига́нды (от лат. ligo – связывать), атомы или группы атомов, непосредственно связанные с центральным атомом (комплексообразователем) в комплексных соединениях. Большинство лигандов являются нейтральными молекулами CO, H2O, O2, CO2, N2, NH3, C2H4, C6H6, C5H5N, H2NCH2C, H2NH2 и др.) или отрицательно заряженными ионами F–, Cl–, Br–, I–, CN–, O2–, O22–, NO2–, SO42–, PO43–, C2O42–, CH3COO–, OH–, H– и др.). С центральным атомом лиганда могут быть связаны σ- или π-связями; эти связи могут быть как двухцентровыми, так и многоцентровыми. В случае двухцентровых связей в составе лиганда можно выделить донорные центры (координирующие атомы – O, N, P, S, As и другие или кратные связи). Многоцентровые связи осуществляются за счёт π-системы ароматических (бензола, циклопентадиенилат-аниона и др.) или гетероароматических (пиррол, тиофен и др.) лигандов. Основной количественной характеристикой лигандов является дентатность (от лат. dens, род. падеж dentis – зуб), которая определяется числом донорных центров лигандов, участвующих в образовании комплекса. Лиганды подразделяются на моно-, ди-, …, полидентатные. Среди полидентатных лигандов важную роль в биохимических процессах играют макрогетероциклические лиганды (например, порфириновые). Для монодентатных лигандов координационное число центрального атома равно числу лигандов, в случае полидентатных лигандов – числу таких лигандов, умноженному на дентатность. Лиганды, координирующиеся через два или более донорных атомa к одному центральному атому, называются хелатными. Лиганды, координирующиеся к различным центральным атомам, – мостиковыми. Природа лигандов, как и свойства центрального атома, определяет свойства, строение, реакционную способность комплексных соединений и, следовательно, возможность их практического применения.