КРА́УН-ЭФИ́РЫ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
КРА́УН-ЭФИ́РЫ (краун-соединения), макрогетероциклические соединения, содержащие в цикле св. 11 атомов, из которых не менее 4 – гетероатомы (O, N, S), связанные между собой этиленовыми мостиками. Молекулы краун-соединений имеют конформацию короны, что и определило назв. веществ этого класса (от англ. crown – корона). Впервые синтезированы Ч. Педерсеном в 1967. За открытие и исследование свойств макрогетероциклических соединений Ч. Педерсену, Д. Краму и Ж. М. Лену присуждена Нобелевская пр. (1987).
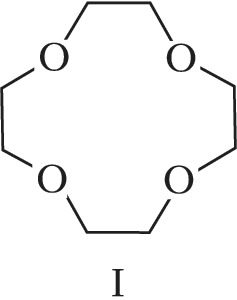
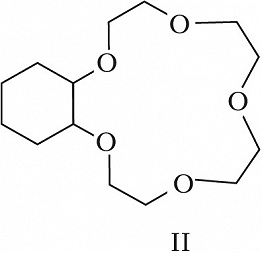
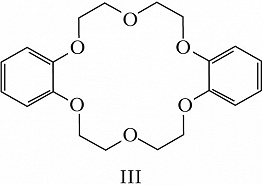
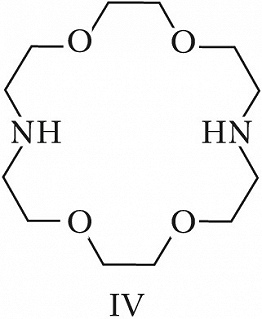
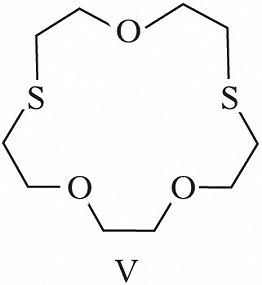
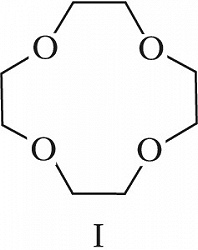
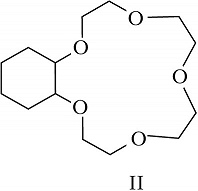
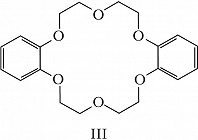
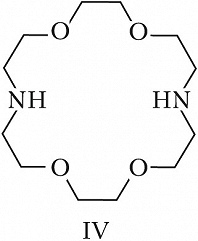
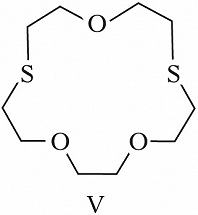
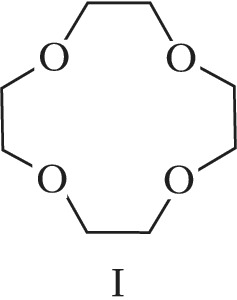
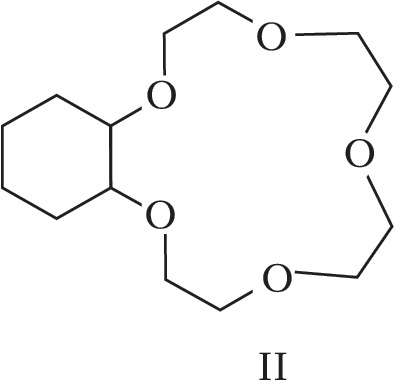
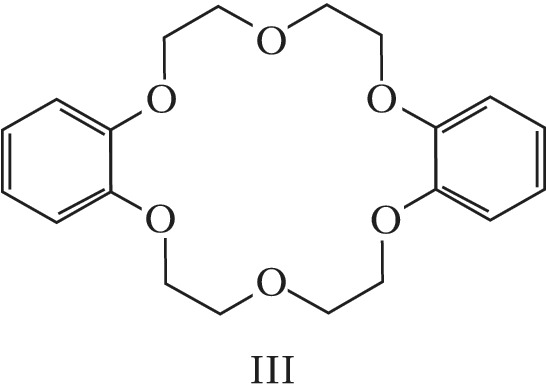
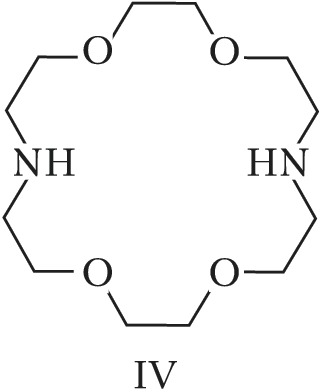
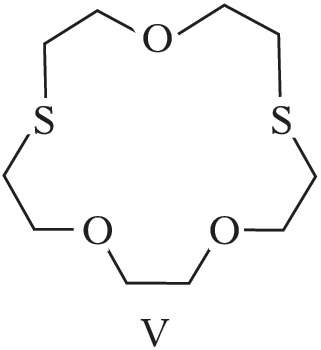
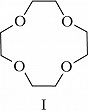
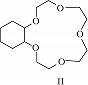
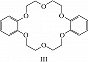
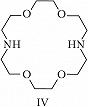
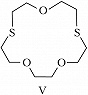
Структура простейшего К.-э. представлена формулой I. Получены краун-соединения, содержащие в цикле др. гетероатомы (Р, Si, As), функциональные группы (сложноэфирные и пр.), а также конденсированные с одним или несколькими бензольными, циклогексановыми кольцами (в т. ч. замещёнными). В тривиальных названиях К.-э. общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят соответственно перед и после слова «краун»; напр., 12-краун-4 (формула I), циклогексано-15-краун-5 (II), дибензо-18-краун-6 (III), 1,10-диаза-18-краун-6 (IV), 1,7-дитиа-15-краун-5 (V).
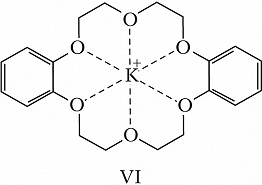
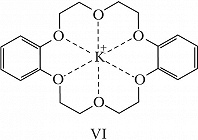
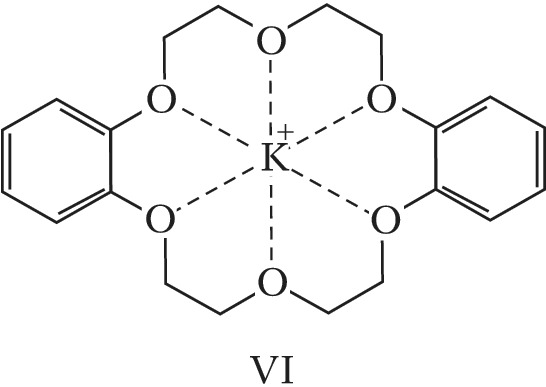
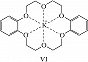
К.-э. – вязкие жидкости или кристаллич. вещества; растворяются в воде и в большинстве органич. растворителей. Химич. свойства определяются природой гетероатома и функциональных групп. К.-э. образуют макроциклические комплексные соединения как с катионами, так и с нейтральными молекулами. В комплексах К.-э. с катионами металлов (щелочных, щёлочноземельных и др.) катион включается во внутримолекулярную полость К.-э. и удерживается там благодаря ион-дипольному взаимодействию с гетероатомами (один из способов расположения катиона металла в полости К.-э. представлен формулой VI). Селективность связывания и устойчивость образуемых К.-э. комплексов зависит от ряда факторов – геометрич. соответствия размеров внедряющейся частицы и полости макроцикла, природы растворителя, хелатного и макроциклического эффектов, заряда внедряющейся частицы, природы противоиона и пр. За счёт комплексообразования К.-э. повышают растворимость солей щелочных и щёлочноземельных металлов в малополярных растворителях; пример – образование малинового бензола и оранжевого бензола (окислительных реагентов) при растворении в бензоле соответственно KMnO4 или K2Cr2O7 в присутствии К.-э. Щелочные металлы в присутствии К.-э. растворяются в координирующих органич. растворителях; интенсивный синий цвет образующихся растворов объясняется присутствием в них сольватированной формы свободных электронов (получаемый раствор является восстановительным реагентом). К.-э. способны селективно экстрагировать ионы металлов и некоторые органич. соединения (амины, аминокислоты и др.) из водной фазы в органическую, энантиоспецифически связывать хиральные молекулы (в частности, протонированные формы аминокислот). За счёт влияния на ионную и субстратную проницаемость биологич. мембран, на ферментные системы и др. биохимич. процессы К.-э. проявляют разл. виды биологич. активности.
К.-э. получают в осн. конденсацией дигалогеналканов или диэфиров п-толуолсульфокислоты (дитозилатов) с полиэтиленгликолями, внутримолекулярной циклизацией монотозилатов полиэтиленгликолей, циклоолигомеризацией этиленоксида. Конденсацию проводят в присутствии катионов металлов (чаще K+, Cs+), внутримолекулярную циклизацию – в условиях высокого разбавления.
К.-э. широко используют в науч. исследованиях как доступные и разнообразные модели при изучении сложных природных супрамолекулярных систем. С помощью К.-э. можно избирательно выводить из организма ионы тяжёлых металлов или вводить малые количества нужных ионов или молекул. К.-э. применяют для концентрирования, разделения, очистки и регенерации металлов, в т. ч. лантаноидов, для разделения нуклидов, энантиомеров; для создания ионоселективных датчиков и мембран; в межфазном катализе и для ускорения реакций, проходящих с участием анионов; как лекарственные препараты, пестициды, антидоты.