МОДЕ́ЛИ МОЛЕКУЛЯ́РНЫЕ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
МОДЕ́ЛИ МОЛЕКУЛЯ́РНЫЕ, наглядное изображение молекул органич. и неорганич. соединений, позволяющее судить о взаимном расположении атомов, входящих в молекулу. М. м. используют в тех случаях, когда по структурной формуле трудно или практически невозможно представить пространственное расположение атомов, в частности при изучении пространственной изомерии, в конформационном анализе, для оценки стерических препятствий.
Различают два осн. типа М. м.: 1) скелетные, приближённо отражающие ориентацию валентных связей, а иногда и орбиталей в пространстве, но не дающие представления об относит. размерах атомов; 2) объёмные, отображающие валентные углы, ковалентные радиусы атомов и их эффективные радиусы, близкие по значениям к ван-дер-ваальсовым.
К первому типу относятся известные с сер. 19 в. модели из шариков, соединённых отрезками проволоки (модели Кекуле – Вант-Гоффа). Более совершенны модели Дрейдинга (предложены в 1959 швейц. химиком А. Дрейдингом), состоящие из стальных стержней и трубок, соединённых в точке, изображающей ядро атома, под углами, равными валентным. Длины трубок и стержней пропорциональны длинам связей между атомами $\ce{H}$ и элемента (0,1 нм соответствует 2,5 см). Свободные концы трубок и стержней изображают ядра атомов Н, поэтому каждый фрагмент в отдельности является моделью молекулы простейшего водородного соединения к.-л. элемента ($\ce{CH_4, NH_3, H_2O, H_2S}$ и т. д.). Для сборки модели более сложного соединения стержень одного фрагмента вставляют в трубку другого; благодаря ограничит. устройству расстояние между центрами фрагментов пропорционально соответствующему межатомному расстоянию. Модели Дрейдинга верно отражают межатомные расстояния и валентные углы в молекулах. Они позволяют имитировать внутр. вращение, оценивать энергетич. выгодность разл. конформаций, измерять расстояния между непосредственно не связанными атомами. Модели Дрейдинга особенно широко применяют при изучении стереохимии полициклич. систем типа стероидов.
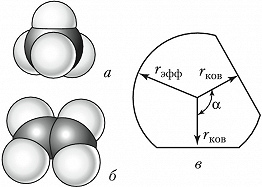
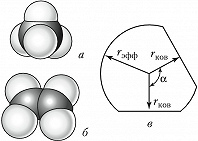
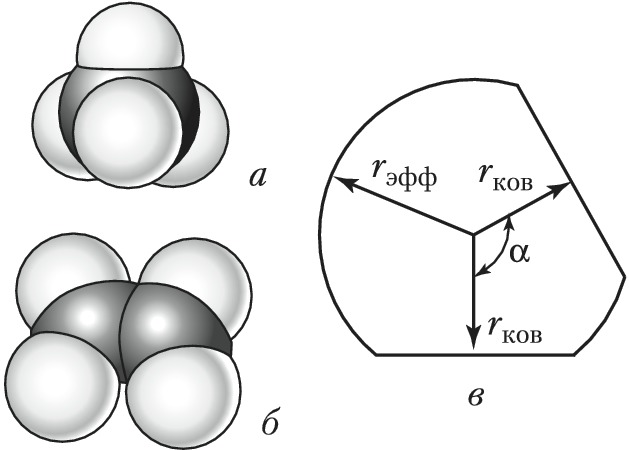
Объёмные модели, правильно передающие размеры и форму молекул, были разработаны в 1934 нем. физиком Г. Стюартом и позднее усовершенствованы нем. физиком и химиком Г. Бриглебом (рис., а, б). Каждый фрагмент, изображающий атом определённого элемента, в моделях Стюарта представляет собой шаровой сегмент, причём радиус шара пропорционален эффективному радиусу атома ($r_{\text{эфф}}$), а расстояние от центра шара до плоскости среза – ковалентному радиусу ($r_{\text{ков}}$). В случае многовалентных атомов делают соответствующее число срезов, причём угол $α$ между перпендикулярами из центра шара на плоскости среза равен валентному (рис., в). По предложению Г. Бриглеба для атомов, соединённых кратными связями, сегменты изготовляют не из шаров, а из эллипсоидов, большая полуось которых соответствует эффективному радиусу, обусловленному наличием $π$-электронного, а малая – $σ$-электронного облака. Модели изготовляют обычно из пластмассы, окрашенной в цвета, установленные для каждого химич. элемента ($\ce{C}$ – чёрный, $\ce{H}$ – белый, $\ce{O}$ – красный, $\ce{N}$ – синий, $\ce{S}$ – жёлтый и т. д.). При сборке моделей сегменты соединяют между собой по плоскостям срезов, причём в случае простых связей сегменты могут вращаться один относительно другого. Модели Стюарта – Бриглеба верно передают валентные углы, межатомные расстояния и эффективные радиусы; они позволяют измерять расстояния между разл. атомами и группами (0,1 нм соответствует 1,5 см). Эффективные радиусы, принятые в моделях Стюарта – Бриглеба, на 10–15% меньше ван-дер-ваальсовых радиусов, получаемых из кристаллографич. данных. Это связано с тем, что модели предназначены для рассмотрения стерических эффектов в молекуле, находящейся при обычных условиях, а не при темп-ре абсолютного нуля.
В связи с развитием компьютерной техники область использования классических М. м. заметно сузилась, поскольку во многих случаях они могут быть с успехом заменены виртуальными моделями, построенными на основании эксперим. структурных данных и результатов квантовохимич. расчётов, выполненных доступными для персональных компьютеров полуэмпирич. методами (см. Компьютерное моделирование в химии). Существующие программы позволяют видеть на экране и фиксировать на бумаге как скелетные, так и объёмные М. м. под разными углами и с разных сторон, как бы поворачивая молекулу; причём имеется возможность получения необходимых данных о межатомных расстояниях, валентных и диэдрических (двугранных) углах. Виртуальные модели могут быть использованы не только в процессе химич. исследований, но и для демонстрации в средней и высшей школе (при наличии необходимого оборудования).