КРИСТАЛЛИЗА́ЦИЯ
-
Рубрика: Физика
-
-
Скопировать библиографическую ссылку:
КРИСТАЛЛИЗА́ЦИЯ, образование кристаллов из расплавов, растворов, газовой фазы или плазмы, а также из аморфных веществ или кристаллов др. структуры. В процессе К. атомы, молекулы или ионы вещества выстраиваются в кристаллическую решётку. К. является неравновесным фазовым переходом 1-го рода. Условия равновесия кристалла со средой (расплавом, паром, раствором и др.) определяются как фазовое равновесие агрегатных состояний вещества при фазовых переходах 1-го рода: равенство темп-ры, давления и химич. потенциала. Необходимое условие роста кристалла – отклонение от равновесия, определяемое переохлаждением (отличием темп-ры от равновесной) и пересыщением (отличием давления или концентрации от равновесных значений). Термодинамич. движущая сила фазового перехода тем выше, чем больше отклонение от равновесия. Переход вещества в кристаллич. фазу сопровождается выделением скрытой теплоты К., и при неполном отводе этой теплоты возможно уменьшение отклонения от равновесия и замедление процесса. Как фазовый переход 1-го рода К. сопровождается скачком удельного объёма по отношению к исходной фазе, и это может приводить к изменению давления в кристаллизующейся системе. Таким образом, К. – это сложный процесс тепломассопереноса, который управляется термодинамич. и кинетич. факторами. Многие из них трудно контролировать. Уровень чистоты, темп-ра и концентрация компонентов в непосредственной близости к фазовой границе, перемешивание, теплообмен могут быть гл. факторами, определяющими размер, число и форму возникающих кристаллов.
Центры кристаллизации
Процесс К. состоит из двух стадий: зарождение центров К. и рост кристаллов. Начальная стадия – зарождение центров К. – представляет собой образование кластеров с характерной для кристалла упорядоченностью. Но иногда их структура может отличаться от структуры устойчивого макроскопич. кристалла. Образование таких кластеров в чистых жидкостях или газах происходит ниже темп-ры плавления массивного кристалла в результате случайных столкновений при тепловом движении атомов или молекул. При темп-рах ниже равновесной объединение частиц в кристаллич. кластер термодинамически выгодно, но появление его новой поверхности требует затраты энергии, что является препятствующим фактором при зарождении центров К. Чем меньше кластер, тем бóльшая доля частиц составляет его поверхность. Поэтому при малых размерах большинство кластеров распадается вследствие флуктуаций колебательной энергии частиц. С ростом кластера доля поверхностной энергии уменьшается по отношению к объёмной энергии объединения частиц, что повышает устойчивость кластера. При заданном пересыщении существует критич. размер, при превышении которого кластеры способны к дальнейшему росту и становятся центрами кристаллизации.
Численной характеристикой интенсивности зарождения центров К. является частота зародышеобразования (нуклеации) – число центров, возникающих в единицу времени в единице объёма среды. Существующая теория объясняет температурную зависимость частоты нуклеации и связывает её с параметрами среды, в которой идёт образование центров К. Для жидкостей с малой вязкостью, напр. для большинства расплавленных металлов, теория предсказывает большие переохлаждения, при которых должно наблюдаться спонтанное зарождение центров К. При дальнейшем увеличении переохлаждения частота нуклеации быстро возрастает, достигая максимума при темп-ре, приблизительно равной одной трети темп-ры равновесия кристалла с расплавом. Быстрый спад частоты зарождения центров К. при ещё более низких темп-рах обусловлен замедлением теплового движения и сильным возрастанием вязкости. Для более вязких жидкостей максимум частоты сдвинут в сторону более низких переохлаждений и сами значения частоты значительно ниже.
Поскольку мн. параметры теории известны с недостаточной для расчётов точностью, важную роль играют эксперим. данные. Приближение к идеальным условиям достигается использованием в опытах малых капель жидкостей диаметром от нескольких микрометров до нанометров. При спонтанном зарождении требуются большие отклонения от равновесия, а центры К. характеризуются критич. размером порядка одного нанометра. Напр., для расплавов чистых металлов наблюдаемая в опытах темп-ра спонтанного зарождения центров К. составляет 30–50% от темп-ры плавления. Мн. силикатные расплавы при охлаждении вообще затвердевают без К., образуя стёкла. Экспериментально показано, что в вязких жидкостях процесс зарождения центров К. нестационарен. Это означает, что характерная для заданного отклонения от равновесия частота зарождения центров К. появляется только по истечении времени запаздывания, которое может быть достаточно большим, сравнимым или даже превышающим время охлаждения образца. Металлич. расплавы характеризуются значительно меньшей вязкостью, и подавление спонтанного зарождения центров К. для некоторых сплавов возможно лишь при очень быстром охлаждении (со скоростью св. 106 К/c). Это лежит в основе технологии получения аморфных металлов. Стабильность аморфного состояния обеспечивается сильным замедлением обмена атомами между кристаллом и средой при низких темп-рах. Наблюдать К. полученного таким образом аморфного состояния можно при нагревании, увеличивая интенсивность теплового движения, а выделяющаяся при этом скрытая теплота фазового перехода может существенно интенсифицировать процесс, дополнительно повышая темп-ру. Для некоторых веществ (германий, кремний, аморфный лёд) наблюдается взрывная К. аморфного состояния.
В загрязнённых средах центры К. возникают на посторонних кристаллич. частицах при гораздо меньших отклонениях от равновесия. Частота зарождения центров К. в таких случаях зависит также от материала стенок сосуда, действия излучений. Зародышевые кристаллы на хорошо смачивающейся ориентирующей поверхности имеют приблизительно куполообразную форму, затратная доля поверхностной энергии у них меньше по сравнению с объёмным выигрышем при агрегировании частиц в такой кристаллик. Поэтому такое гетерогенное зарождение центров К. происходит при меньших переохлаждениях. Контролируемое гетерогенное зарождение центров К. используется, напр., при эпитаксиальном получении монокристаллич. плёнок. При выращивании на затравочном центре К. крупных совершенных монокристаллов, содержащих минимально возможное число дефектов, необходимо избегать появления спонтанных зародышей. Для этого используют небольшое отклонение от условий равновесия. В металлургии при получении кристаллич. материалов стремятся получить макс. число центров К., для чего создают глубокое переохлаждение расплавов.
Механизмы роста кристаллов
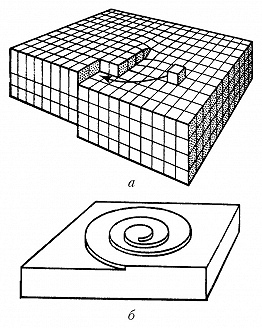
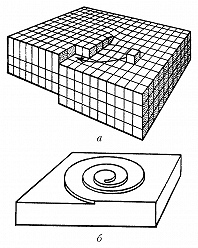
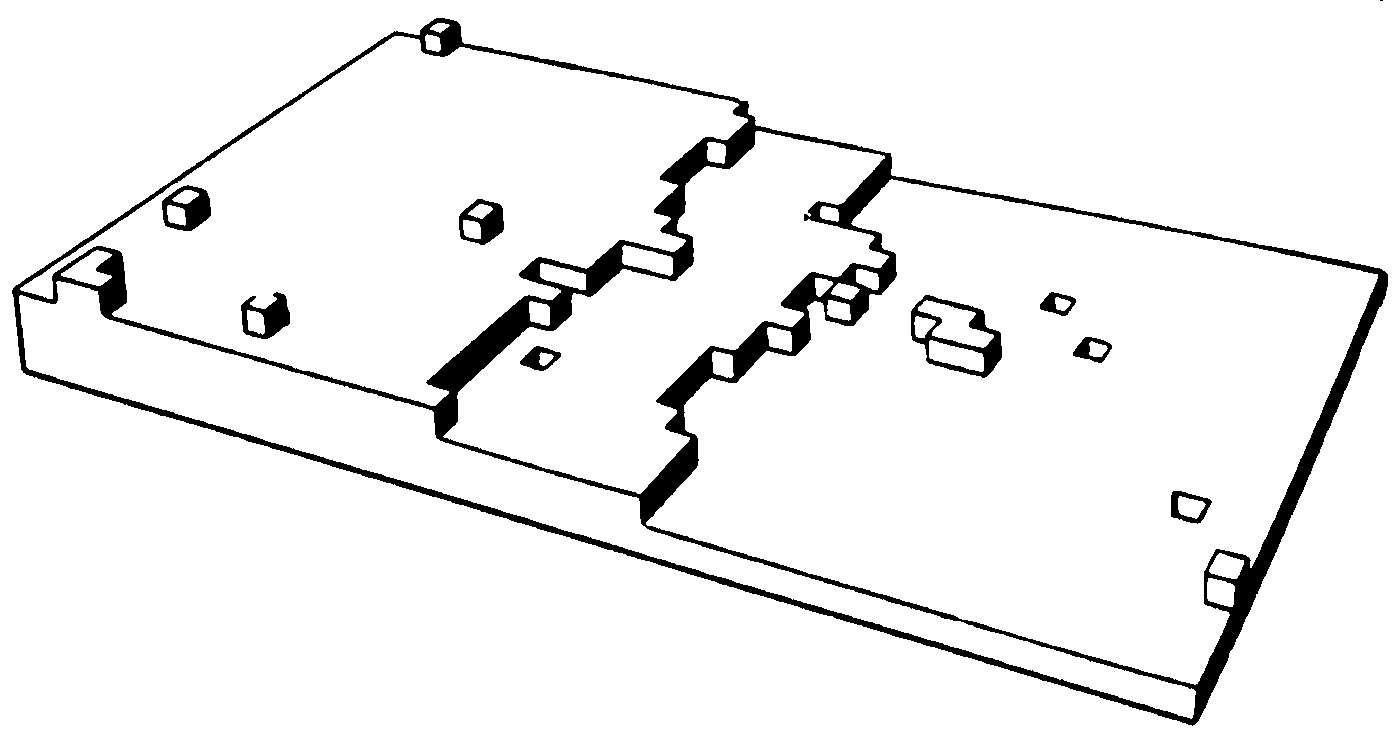
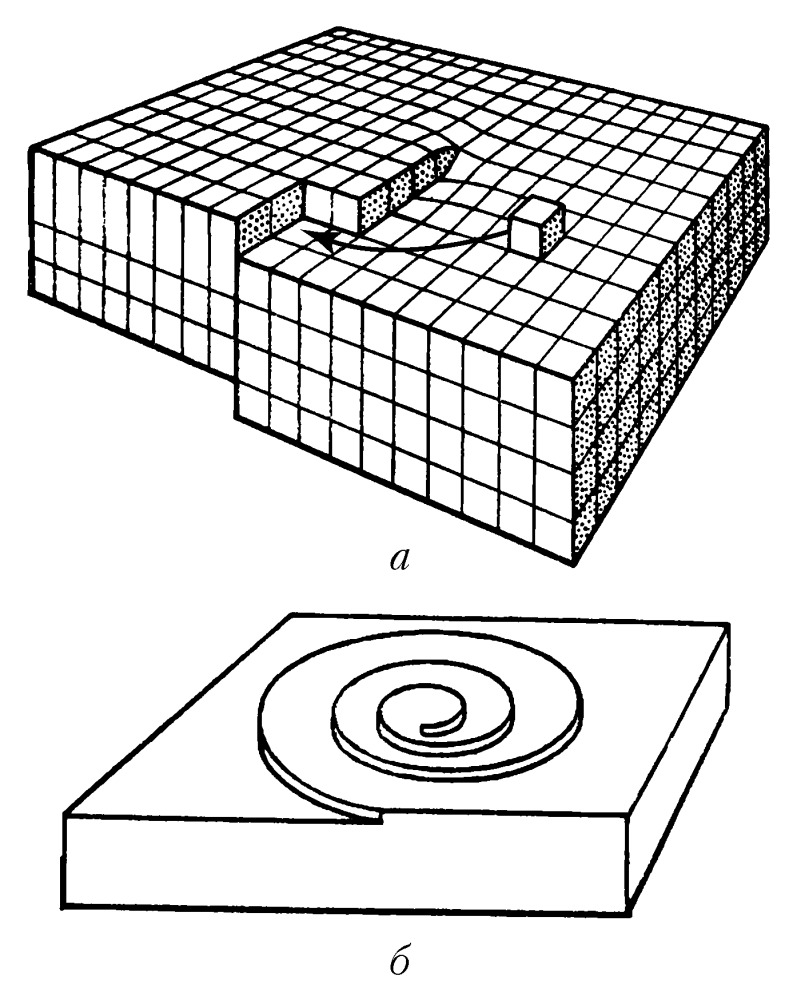
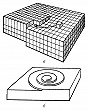
В зависимости от того, какой является поверхность кристалла в атомном масштабе – гладкой или шероховатой, различают два механизма роста кристаллов: послойный и нормальный. Атомно-гладким поверхностям обычно отвечают наиболее развитые грани с простыми кристаллографич. индексами. Они содержат сравнительно небольшое число дефектов: вакансий и адсорбированных атомов. Края незавершённых атомных плоскостей образуют ступени (рис. 1), которые, в свою очередь, имеют небольшое число изломов. Элементарный акт роста кристалла состоит в присоединении новой частицы к излому и не меняет поверхностную энергию. Последовательное присоединение частиц к излому приводит к его движению вдоль ступени, а ступени по поверхности – такой рост называется послойным. Плотность ступеней при послойном росте зависит от механизма их генерации. Ступени могут возникать в результате образования и роста двумерных зародышей. Процесс образования двумерных зародышей, способных к дальнейшему росту на атомно-гладкой поверхности, имеет некоторую аналогию с образованием центров К. в жидкости. Двумерный зародыш также имеет критич. размер, начиная с которого он способен к дальнейшему росту. При агрегировании двумерного зародыша препятствующим фактором его развития при малых размерах является затрата работы на линейную энергию его периметра. Но с ростом размера доля линейной энергии периметра становится всё меньше, и, начиная с некоторого критич. размера, двумерный зародыш становится центром роста новой ступени. Частота образования двумерных зародышей очень мала при малых отклонениях от равновесия, соответственно мала и скорость роста, определяемая двумерным зародышеобразованием. Заметные скорости роста при таком механизме образования ступеней начинаются при ощутимом переохлаждении и очень сильно (экспоненциально) возрастают при его увеличении. Др. механизм генерации ступеней связан с винтовыми дислокациями. Если кристалл содержит винтовую дислокацию, то его рост происходит путём присоединения атомов к торцу ступени, оканчивающейся на дислокации (рис. 2,а). При росте на винтовой дислокации ступень приобретает спиральную форму (рис. 2,б), а заметная скорость роста увеличивается с переохлаждением по квадратичному закону и наблюдается уже при малых отклонениях от равновесия.
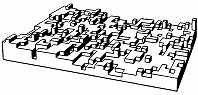
На атомно-шероховатых поверхностях (рис. 3) плотность изломов велика и присоединение новых частиц к кристаллу происходит практически в любой точке его поверхности. Такой рост называется нормальным. Его скорость линейно увеличивается с переохлаждением. Теория роста кристалла связывает плотность упаковки поверхности кристалла с энергией связи между частицами поверхности кристалла и теплотой К. Считается, что если энергия связи достаточно велика, все плотноупакованные грани – гладкие. Это характерно для кристаллов, растущих из пара. Теплота К. расплавов, как правило, значительно ниже, чем теплота К. из пара, поэтому и энергия связи частиц в кристалле по сравнению с расплавом меньше, чем по сравнению с паром. В связи с этим поверхность кристалла, растущего из расплава, обычно шероховатая, что определяет нормальный рост и формирование округлённых граней. Переход от шероховатости к огранению возможен при изменении концентрации в двухкомпонентных системах при росте кристалла из раствора. В кристаллах германия и кремния, растущих из расплава, можно наблюдать сосуществование плоских и округлённых граней.
Формы роста кристаллов
определяются анизотропией их свойств и условиями тепломассопереноса в процессе К. Кристаллы с шероховатыми поверхностями имеют обычно округлую форму. При выращивании таких кристаллов из-за большой скорости поверхностных процессов переохлаждение на границе с расплавом малó и растущая поверхность повторяет форму изотермы температурного поля в системе при темп-ре равновесия. Атомно-гладкие поверхности проявляются в виде граней. Равновесная форма кристаллич. многогранника такова, что расстояние от центра до каждой грани пропорционально величине её поверхностной энергии. Равновесная форма является и стационарной формой роста, но в реальном процессе роста она может быть сильно искажена из-за неустойчивости поверхности роста при конечном (а не бесконечно малом) переохлаждении, влиянии примесей.
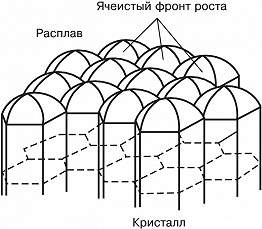
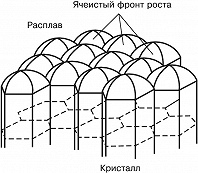
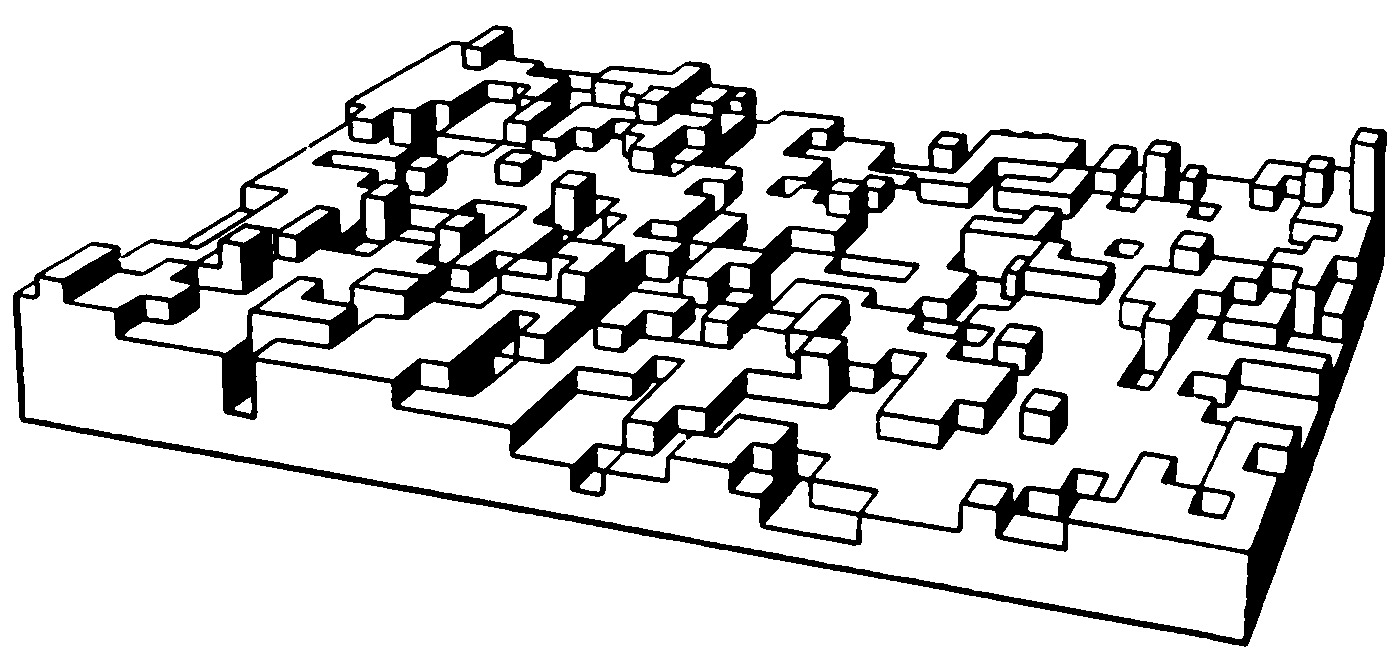
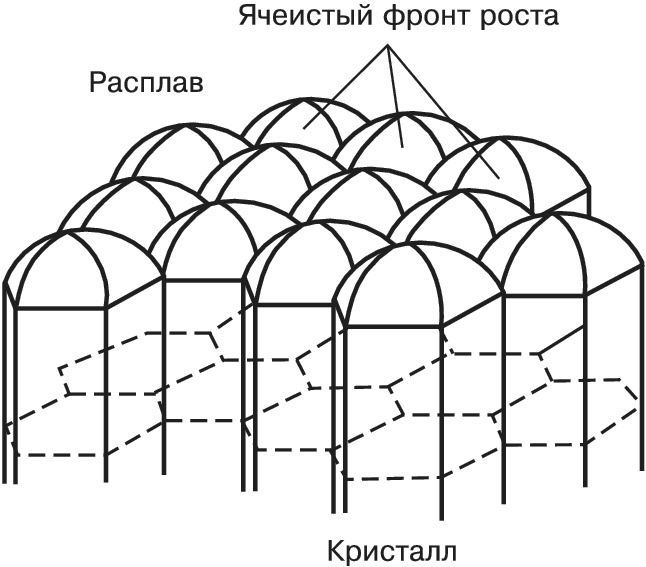
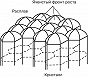
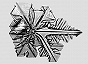
Если расплав сильно переохлаждён и темп-ра в расплаве убывает по мере удаления от фронта роста, то рост неустойчив: случайно возникший на поверхности кристалла выступ попадает в область большего переохлаждения, и скорость его роста увеличивается. Такая неустойчивость для плоского фронта К. ведёт к образованию полосчатой или ячеистой структуры кристалла (рис. 4). При росте маленького кристалла эта неустойчивость проявляется начиная с некоторого размера кристалла. На нём развиваются выступы, и он приобретает скелетную или дендритную форму, которая характеризуется появлением вторичных ветвей после достижения первичным выступом критич. длины (рис. 5). Рост больших огранённых кристаллов из неподвижного раствора может быть также неустойчив. Пересыщение в этом случае выше у вершин и рёбер кристалла и меньше в центр. частях грани. Поэтому вершины становятся ведущими источниками роста слоёв. При большой разности пересыщений на вершинах и в центрах граней вершины обгоняют центры граней и возникает скелетная форма кристалла (рис. 6). При заданной темп-ре в двухкомпонентной системе равновесие может существовать при разных составах кристалла и расплава. При росте кристалла один из компонентов скапливается перед фронтом, вызывая концентрационное переохлаждение, и это часто приводит к неустойчивости фронта роста.
Разные грани кристалла при росте захватывают разные количества примесей, содержащихся в среде. Так возникает его секториальное строение. Если кристалл плохо захватывает примесь, происходит её накопление перед фронтом роста. Периодич. захват этого пограничного слоя растущим кристаллом приводит к формированию зонарной структуры (рис. 7). Захват примесей приводит к изменению параметров кристаллич. решётки, и на границах областей разного состава возникают внутр. напряжения, что приводит к образованию дислокаций и трещин. Дислокации возникают в результате релаксации упругих напряжений в неравномерно нагретом кристалле или могут переходить из затравки в выращиваемый кристалл.
Массовая кристаллизация –
одновременный рост множества кристаллов, широко используемый в пром-сти. Свойства слитков и отливок при К. металлургич. расплавов в сильной степени зависят от количества центров К. и условий их роста. При затвердевании отливок металлов центры К. появляются вначале на охлаждаемых стенках изложницы, куда заливают расплавленный металл. Из хаотически ориентированных кристаллов выживают те, которые растут перпендикулярно стенке. Они формируют столбчатую зону вблизи стенки. Конвекционные потоки в расплаве могут обламывать ветви дендритов, поставляя в расплав вторичные центры К. Массовая К. в растворах начинается на гетерогенных центрах К. или на специально введённых затравочных кристаллах. Столкновения этих кристалликов между собой и со стенками сосуда в перемешиваемом растворе дают начало вторичным центрам К. Для создания дополнит. центров К. используют УЗ-дробление растущих кристаллов или добавки поверхностно-активных веществ. Массовая К. используется также для очистки веществ от примесей.
Применение кристаллизации
В природе К. приводит к образованию минералов, льда, играет важную роль во многих биологич. процессах. К. происходит также при некоторых химич. реакциях, в процессе электролиза. Она лежит в основе мн. технологич. процессов: в металлургии, при получении материалов для электроники, оптики. Путём К. получают массивные монокристаллы и тонкие плёнки. К. широко используется в химич., пищевой, мед. пром-сти: в технологии очистки веществ, при произ-ве соли, сахара, лекарств.