Фотохимические реакции
Фотохими́ческие реа́кции, химические реакции, протекающие под действием света. Молекула при поглощении кванта света переходит из основного электронного состояния в одно из возбуждённых состояний. Возбуждённые состояния молекул имеют отличную от основного состояния электронную структуру и, как правило, более высокую реакционную способность. Возбуждённые молекулы вступают в химические реакции, первичные продукты которых (ионы, радикалы, изомеры) чаще всего оказываются нестабильными. Конечные продукты фотохимических реакций образуются в результате обычных термических реакций, которые протекают либо непосредственно с участием первичных частиц, либо как ряд последовательных химических превращений. Основная характеристика фотохимических реакций – квантовый выход, который определяется отношением количества образующихся молекул продукта фотохимических реакций к числу поглощённых исходным веществом квантов света. При классификации фотохимических реакций, помимо общепринятых признаков – по типам разрываемых и образуемых связей, важное значение имеют механизмы разрыва и образования связей. Основные типы фотохимических реакций: фотодиссоциация, фотохимическое окисление-восстановление, фотоизомеризация, фотоприсоединение, фотозамещение, фотохимический отрыв атомов.
Фотодиссоциация
Фотодиссоциация – распад возбуждённой молекулы по какой-либо связи на радикалы, атомы или ионы, например: . Фотодиссоциация типична для таких возбуждённых состояний, в которых электрон находится на разрыхляющей s*-орбитали. В конденсированных средах первичные продукты фотодиссоциации оказываются в «клетке», образованной частицами растворителя, и могут рекомбинировать с образованием исходных молекул, что приводит к существенному снижению квантового выхода по сравнению с фотохимической реакцией в газовой фазе, где квантовый выход часто близок к единице. Фотодиссоциация – первичная стадия многих реакций замещения, стадия инициирования в цепных реакциях. Фотодиссоциация может протекать как гомолитически, так и гетеролитически. Например, распад лейкооснований триарилметановых красителей протекает в результате гетеролитической фотодиссоциации:
Фотовосстановление и фотоокисление
Фотовосстановление и фотоокисление в большинстве случаев связаны с переносом электрона. Образующиеся в первичной стадии ион-радикалы вступают в дальнейшие превращения, давая продукты окисления или восстановления. Например, при взаимодействии тетраметил-1,4-бензохинона с донорами электрона (аминами, спиртами) под действием света первоначально образуются семихиноновые анион-радикалы, диспропорционирование которых даёт хинон и гидрохинон. Подобным образом происходит фотовосстановление красителей (акридиновых, оксазиновых, тиазиновых) до лейкосоединений. Аналогично из ароматических углеводородов в присутствии доноров электрона получаются анион-радикалы, которые в протонных растворителях присоединяют протон и дают продукты диспропорционирования, рекомбинации и др. В координационных соединениях часто наблюдается фотоперенос электрона между центральным ионом и лигандом, что приводит к образованию окисленной и восстановленной форм, например:
Перенос электрона может происходить не только при взаимодействии возбуждённых молекул с донором или акцептором электрона, но и путём прямой фотоионизации молекул. При фотоионизации, например, аминов в замороженных растворах наблюдается образование их катион-радикалов. Фотовосстановление и фотоокисление могут протекать и не через стадии переноса электрона. Так, фотовосстановление карбонильных, гетероциклических и нитроароматических соединений происходит путём отрыва возбуждёнными молекулами атома водорода от молекулы растворителя. Фотоокисление кислородом часто протекает вследствие фотосенсибилизированного превращения молекулярного кислорода, основное состояние которого является триплетным, в синглетное состояние. Синглетный кислород легко присоединяется по кратным связям.
Фотоизомеризация
Фотоизомеризация включает стереоизомеризацию, таутомерные превращения, перегруппировки. Широко распространены процессы цис-транс- и транс-цис-фотоизомеризации ненасыщенных соединений (например, диарилэтиленов). Часто наблюдаются фотоперегруппировки в ряду ароматических и циклических ненасыщенных соединений (например, бензола и его производных в бензвален, фульвен и призман). В результате фотоизомеризации протекают реакции циклизации.
Фотоприсоединение
Фотоприсоединение к возбуждённым молекулам различных реагентов характерно для многих ненасыщенных соединений. Такие фотохимические реакции обычно протекают по синхронному механизму. Типичные примеры – образование циклобутановых соединений.
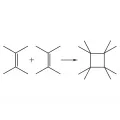 Образование циклобутановых соединений.
Образование циклобутановых соединений.
Фотозамещение
Фотозамещение в органических соединениях может протекать как по радикальному, так и по гетеролитическому механизму. Фотозамещение в алифатических соединениях протекает в основном по радикальному пути: , , . Фотозамещение в ароматических соединениях часто протекает по цепному радикальному или по цепному гетеролитическому механизму.
Отрыв атомов
Отрыв атомов (гомолитический) возбуждёнными молекулами от реагента (или растворителя) характерен для возбуждённых состояний, имеющих неспаренный электрон на несвязывающей орбитали, например для n,π*-состояний карбонильных и гетероциклических соединений:
Первично образующиеся радикалы вступают во вторичные реакции рекомбинации или диспропорционирования, что приводит к стабильным конечным продуктам (в данном примере 1,2-гликолям или спиртам – продуктам восстановления исходного кетона). Внутримолекулярные реакции отрыва атома водорода характерны для карбонильных соединений с достаточно длинными (более двух атомов C) заместителями, например:
Промежуточный бирадикал распадается на два ненасыщенных фрагмента – олефин и енол, последний изомеризуется в кетон. Эта реакция носит название реакции Норриша типа II. Реакция Норриша типа I включает фотодиссоциацию по связям, примыкающим к карбонильной группе:
