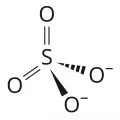
Сульфаты
Сульфа́ты, производные серной кислоты H2SO4: соли (неорганические сульфаты) и эфиры (органические сульфаты).
Неорганические сульфаты
Среди неорганических различают средние сульфаты с анионом SO42– (например, сульфат кальция CaSO4, сульфат натрия Na2SO4), кислые (или гидросульфаты) с анионом HSO4– (например, гидросульфат натрия NaHSO4) и оснóвные, содержащие, наряду с анионом SO42–, группы ОН– [например, гидроксосульфат цинка Zn2(OH)2SO4]. В природе существуют двойные и тройные неорганические, а также смешанные соли с анионом SO42–.
Неорганические сульфаты – кристаллические вещества; средние и кислые сульфаты хорошо растворимы в воде (практически нерастворимы сульфаты бария BaSO4 и радия RaSO4, малорастворимы сульфаты кальция CaSO4, стронция SrSO4 и свинца PbSO4), осно́вные сульфаты –  Внешний вид медного купороса.малорастворимы или практически нерастворимы. Кристаллогидраты сульфатов некоторых металлов в степени окисления +2 называются купоросами (например, медный купорос CuSO4·5H2O), двойных сульфатов – квасцами. Средние сульфаты щелочных металлов термически устойчивы, кислые – при нагревании разлагаются, превращаясь в пиросульфаты (дисульфаты, анион S2O72–); средние сульфаты других металлов, а также осно́вные сульфаты при сильном нагревании, как правило, разлагаются с образованием оксидов металлов и выделением триоксида серы SO3.
Внешний вид медного купороса.малорастворимы или практически нерастворимы. Кристаллогидраты сульфатов некоторых металлов в степени окисления +2 называются купоросами (например, медный купорос CuSO4·5H2O), двойных сульфатов – квасцами. Средние сульфаты щелочных металлов термически устойчивы, кислые – при нагревании разлагаются, превращаясь в пиросульфаты (дисульфаты, анион S2O72–); средние сульфаты других металлов, а также осно́вные сульфаты при сильном нагревании, как правило, разлагаются с образованием оксидов металлов и выделением триоксида серы SO3.
Неорганические сульфаты получают при взаимодействии H2SO4 с металлами, их оксидами и гидроксидами, а также разложением солей других кислот серной кислотой; применяют как удобрение (сульфат аммония), используют в стекольной, бумажной промышленности, производстве вискозы (сульфат натрия), как сырьё для промышленного получения соединений различных металлов, строительных материалов и др.
Органические сульфаты
Среди органических сульфатов различают алкил(арил)сульфаты – кислые эфиры серной кислоты ROSO2OH (R – органический радикал) и диалкил(диарил)сульфаты – полные эфиры серной кислоты (RO)2SO2, например диметилсульфат (СН3)2SO4.
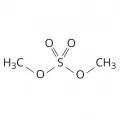 Структурная формула диметилсульфата.Органические сульфаты – высококипящие жидкости или твёрдые вещества; алкилсульфаты и их соли, а также низшие диалкилсульфаты растворяются в воде. Органические сульфаты гидролизуются до спиртов (щелочной гидролиз протекает с разрывом связи С−О, кислотный – с разрывом связи S−О); реагируют с нуклеофильными реагентами с разрывом связи С−О. Диалкилсульфаты сульфируют ароматические соединения, вступают в реакции переалкилирования. Алкилсульфаты, имеющие 2 и более атома С в алкильной группе, подвергаются термическому разложению с образованием алкенов.
Структурная формула диметилсульфата.Органические сульфаты – высококипящие жидкости или твёрдые вещества; алкилсульфаты и их соли, а также низшие диалкилсульфаты растворяются в воде. Органические сульфаты гидролизуются до спиртов (щелочной гидролиз протекает с разрывом связи С−О, кислотный – с разрывом связи S−О); реагируют с нуклеофильными реагентами с разрывом связи С−О. Диалкилсульфаты сульфируют ароматические соединения, вступают в реакции переалкилирования. Алкилсульфаты, имеющие 2 и более атома С в алкильной группе, подвергаются термическому разложению с образованием алкенов.
Промышленный метод синтеза алкил- и диалкилсульфатов – сульфатирование алкенов Н2SО4. Органические сульфаты применяют в органическом синтезе в качестве алкилирующих агентов; соли высших алкилсульфатов – в качестве поверхностно-активных веществ. Введение сульфатных групп в структуру целлюлозы, сахаров, биологически активных веществ, красителей и других соединений используют для получения их водорастворимых форм.
Низшие диалкилсульфаты в пара́х раздражают слизистые оболочки глаз и верхних дыхательных путей, в больших концентрациях поражают лёгочную ткань, в жидком состоянии вызывают раздражение и некроз кожи, при попадании внутрь обладают общетоксичным действием. Высшие алкилсульфаты и диалкилсульфаты малотоксичны.