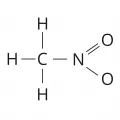
Нитрометан
Нитромета́н, простейшее нитросоединение алифатического ряда, CH3NO2.
Физико-химические свойства
Нитрометан представляет собой бесцветную жидкость с запахом горького миндаля; молярная масса 61,042 г/моль; tпл ‒28,55 °С; tкип 100,8 °С; плотность 1,1371 г/см3; показатель преломления nD20 1,3817; электрический дипольный момент μ 11,67·10-30 Кл·м; вязкость η 0,646 мПа·с (20 °С); коэффициент поверхностного натяжения γ 37,48 мН/м; стандартная энтальпия плавления ΔH°пл 9,7 кДж/моль, стандартная энтальпия испарения ΔH°исп 38,28 кДж/моль, стандартная энтальпия образования ΔH°обр ‒113,1 кДж/моль, стандартная энтальпия сгорания ΔH°сгор ‒708,4 кДж/моль; показатель константы кислотности рКа 10,2. Растворимость нитрометана в воде 9,5 мл в 100 мл, воды в нитрометане 2,2 мл в 100 мл, образует азеотропную смесь с водой (76,4 % по массе нитрометана, tкип 83,6 °С); хорошо растворяется в органических растворителях (кроме алифатических углеводородов). Концентрированные кислоты разлагают нитрометан до NH3, NH2OH, CO2, CO. Нитрометан легко нитрозируется, восстанавливается, галогенируется, карбоксилируется, участвует в азосочетании, конденсируется с альдегидами, кетонами, этиленоксидом и другими соединениями.
По химическим свойствам нитрометан типичный представитель алифатических нитросоединений. Специфические свойства нитрометана связаны с наличием трёх реакционноспособных связей С—Н, а также с нестабильностью метаннитронатов ‒ производных ациформы. На этом основано применение нитрометана в синтезе нитроацетатов:
При взаимодействии нитрометана с пирилиевыми солями образуются ароматические нитросоединения; с помощью нитрометана происходит расширение цикла в циклоалканонах, например:
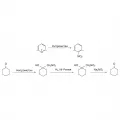 Механизм реакции расширения цикла в циклоалканонах.Для CH3NO2 характерно существование таутомерной кислотной формы CH2N+(OH)O– ‒ т. н. метаннитроновой кислоты; при взаимодействии нитрометана со щелочами образуются соли ‒ метаннитронаты (взрываются при нагревании). Метаннитронаты щелочных металлов с HgCl2 дают гремучую ртуть.
Механизм реакции расширения цикла в циклоалканонах.Для CH3NO2 характерно существование таутомерной кислотной формы CH2N+(OH)O– ‒ т. н. метаннитроновой кислоты; при взаимодействии нитрометана со щелочами образуются соли ‒ метаннитронаты (взрываются при нагревании). Метаннитронаты щелочных металлов с HgCl2 дают гремучую ртуть.
Получение
В промышленности нитрометан получают деструктивным нитрованием низших алканов (например, пропана) 50–70%‑ной HNO3 при 400–700 °С в проточном реакторе (трубка Ni‑Cr, время контакта до 2 с). Из реакционной смеси фракционированием выделяют нитрометан (~ 10 %) и нитропарафины С2–С3; исходный пропан возвращают в реактор. В лаборатории нитрометан получают по реакциям:
Применение
Нитрометан – растворитель для эфироцеллюлозных лаков и смол, экстрагент ароматических углеводородов из их смесей с парафинами, добавка к дизельным топливам, однокомпонентное ракетное топливо. В лаборатории нитрометан используют как растворитель и полупродукт в синтезе различных мононитро-, полинитросоединений, а также соединений с другими функциональными группами.
Нитрометан взрывоопасен, токсичен (вызывает эпилептиформные судороги, обладает наркотическим действием). Предельно допустимая концентрация 30 мг/м3.