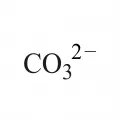Карбонаты
Карбона́ты, соли угольной кислоты. Различают средние карбонаты (нормальные), содержащие анион CO32− (например, карбонат калия K2CO3, карбонат кальция CaCO3, карбонат натрия Na2CO3), кислые карбонаты (гидрокарбонаты), содержащие анион HCO3− (например, гидрокарбонат натрия NaHCO3 – питьевая сода), а также оснóвные карбонаты, содержащие гидроксогруппу; к оснóвным карбонатам относится, например, минерал малахит Cu2CO3(OH)2.
Средние карбонаты – белые кристаллические вещества. Средние карбонаты щелочных металлов, таллия(I) и аммония хорошо растворимы в воде. В результате гидролиза их растворы имеют щелочную реакцию. Средние карбонаты взаимодействуют с диоксидом углерода в водной среде с образованием соответствующих гидрокарбонатов, например:
При нагревании средние карбонаты, кроме карбонатов щелочных металлов, разлагаются на оксид соответствующего металла и диоксид углерода, например:
Гидрокарбонаты – белые кристаллические вещества, хорошо растворимы в воде. Многие гидрокарбонаты существуют только в водных растворах, например гидрокарбонаты кальция и железа(II). При кипячении этих растворов гидрокарбонаты разлагаются с образованием соответствующего карбоната, например:
Гидрокарбонаты, существующие в твёрдом виде, при нагревании также разлагаются, например:
.
Средние карбонаты и гидрокарбонаты взаимодействуют с кислотами с выделением CO2, например:
Природные карбонаты  Малахит.составляют отдельный класс минералов. Средние карбонаты и гидрокарбонаты являются компонентами буферных систем живых организмов. Карбонаты получают действием CO2 на окcиды и гидроксиды металлов или обменными реакциями между солями. Карбонаты применяются в производстве стёкол, моющих средств, в качестве компонентов пекарских порошков, наполнителей бумаги и резины, осушителей, строительных материалов и др.
Малахит.составляют отдельный класс минералов. Средние карбонаты и гидрокарбонаты являются компонентами буферных систем живых организмов. Карбонаты получают действием CO2 на окcиды и гидроксиды металлов или обменными реакциями между солями. Карбонаты применяются в производстве стёкол, моющих средств, в качестве компонентов пекарских порошков, наполнителей бумаги и резины, осушителей, строительных материалов и др.