ДИАГРА́ММА ФА́ЗОВАЯ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
ДИАГРА́ММА ФА́ЗОВАЯ, графическое изображение условий (темп-ры, давления, химич. состава и др.), при которых в равновесной термодинамич. системе, состоящей из одного или нескольких заданных веществ (независимых компонентов системы), существуют однородные состояния вещества (фазы) с различающимися физико-химич. свойствами. Как эквивалентный термину «Д. ф.» используется термин «диаграмма состояния» (гл. обр. в России и Германии). Однако диаграммой состояния нередко, особенно в англоязычной лит-ре, называют также графики, не отражающие непосредственно фазовые равновесия в системе.
Фазы представлены на Д. ф. в виде областей, ограниченных кривыми или поверхностями, расположенными в пространстве независимых термодинамич. переменных. Обычно это темп-ра $T$, давление $P$, мольные доли компонентов системы $x$, функции этих и др. переменных, такие как отношения количеств или концентраций компонентов, плотности $\rho$ или мольные объёмы $V_\text{m}$, парциальные давления или химич. потенциалы веществ $\mu$. При отсутствии внешних силовых полей число координатных осей полной Д. ф. открытой системы с $c$ компонентами равно $c+2$. Для изображения многомерных Д. ф. на плоскости пользуются их сечениями и проекциями, построенными при определённых ограничениях, наложенных на некоторые из независимых переменных, часто в сочетании со специально выбранными системами координат (координаты Дженике, треугольники Гиббса – Розебома и др.). Д. ф. показывает: какие индивидуальные вещества, жидкие, твёрдые или газовые растворы образуют заданные компоненты системы; при каких условиях такие фазы и их гетерогенные смеси являются термодинамически устойчивыми; при каких значениях термодинамич. переменных в системе происходят фазовые превращения веществ. Д. ф., содержащие данные о химич. составе фаз, позволяют также определить относительные количества сосуществующих фаз. Такие сведения необходимы для решения многих науч. и практич. задач и широко используются в химии, металлургии, материаловедении, геохимии и др. областях науки и технологии.
Координатами Д. ф. могут быть термодинамич. переменные двух видов – параметры термич., механич. и химич. равновесий $T$, $P$, $\mu$, имеющие одинаковые значения во всех частях равновесной системы, или (обычно различающиеся в разных фазах) обобщённые плотности экстенсивных свойств, такие как $x$, $\rho$, V_\text{m} и др. свойства, равные отношениям экстенсивных величин к количеству, массе или объёму вещества в системе. В связи с этим различают три типа Д. ф. Диаграммы одного и того же типа являются изоморфными: они имеют одинаковые топологич. особенности независимо от числа компонентов и значений конкретных переменных на координатных осях.
На Д. ф. типа ($T$, $P$), ($T$, $\mu_i$), ($\mu_i$, $\mu_j$) и им подобных, с интенсивными параметрами равновесия, представлены только фазовые области и разделяющие их линии (поверхности), которые обозначают границы стабильности отд. фаз. Точки пересечения линий соответствуют условиям равновесия более двух фаз. Так, тройная точка на ($T$, $P$)-диаграмме однокомпонентной системы указывает на условия устойчивого сосуществования трёх фаз.
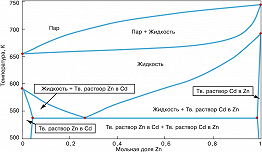
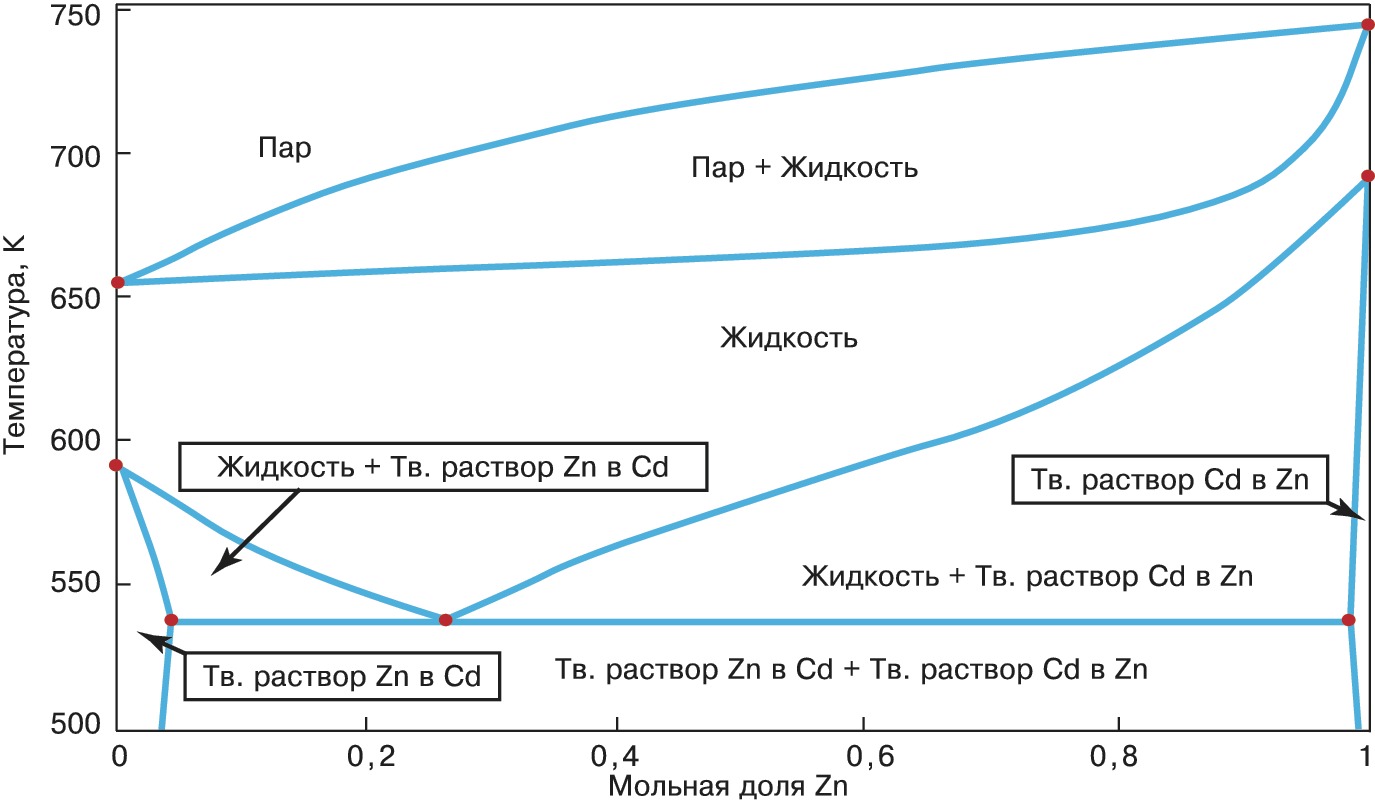
При наличии оси концентраций, мольных свойств, плотностей, как, напр., на Д. ф. ($T$, $x$), ($P$, $x$), ($\mu_i$, $x$), ($T$, $\rho$), области стабильности фаз разделены др. областями, которые отображают существование гетерогенных смесей равновесных фаз. Д. ф. такого типа для двухкомпонентной системы кадмий – цинк показана на рисунке (стр. 706). Диаграмма этой двухкомпонентной системы имеет две координатные оси, а не четыре, как того требует приведённое выше выражение $c+2$, поскольку при её построении использовано условие постоянства $P$ и два независимых переменных количества Cd и Zn заменены одной концентрацией $x_{Zn}(x_{Cd}=1-x_{Zn})$. Верхняя часть рисунка представляет собой диаграмму равновесия жидкость – пар. Ломаная кривая, соединяющая точки плавления чистых компонентов, называется линией ликвидуса, она показывает «диаграмму плавкости» системы. Прямые (коноды), проведённые в гетерогенной области такой Д. ф. между границами двух сосуществующих фаз параллельно оси концентраций (см. эвтектическую коноду на рисунке), позволяют при любом заданном компонентном составе системы определить количества сосуществующих фаз («правило рычага»).
В Д. ф. третьего типа – ($x_i$, $x_j$), ($x_i$, $\rho$ ), (мольная энтропия, $x$), (мольная энтальпия, $x$) и др. – координатами являются только обобщённые плотности экстенсивных термодинамич. свойств. На этих диаграммах также представлены гетерогенные смеси фаз и коноды, но, в отличие от двух др. типов Д. ф., в данном случае состояние гетерогенных смесей отображается плоской или объёмной фигурой (треугольником, тетраэдром) и есть возможность определять количественный фазовый состав системы при равновесии трёх и более фаз («правило центра тяжести» фигуры).
Д. ф. изучают экспериментально и рассчитывают методами химич. термодинамики по данным о термодинамич. свойствах составляющих систему веществ. Теоретич. основания для построения Д. ф. даны Дж. Гиббсом в 1880-х гг. Им же сформулировано «правило фаз» (см. Гиббса правило фаз), широко применяющееся при эксперим. изучении фазовых равновесий и Д. ф.: при фиксированных $T$ и $P$ число равновесно сосуществующих фаз $f$ не может превышать число компонентов системы более чем на два, $f \leq c+2$.