Ароматические соединения
Аромати́ческие соедине́ния (от греч. ἄρωμα – благовония), органические соединения, характеризующиеся главным образом наличием замкнутой системы сопряжённых связей, которая включает, согласно правилу Хюккеля, (4n+2) π-электронов (n = 0, 1, 2, …); удовлетворяют всем или нескольким критериям ароматичности. Наиболее известны и важны: ароматические углеводороды (арены), в том числе моноциклические – бензол и его гомологи (например, ксилолы, кумол, толуол, этилбензол) и полициклические, построенные из бензольных колец, непосредственно связанных друг с другом (например, бифенил), связанных через какую-либо группу (например, дифенилметан), конденсированных (например, антрацен, нафталин); производные аренов (например, фенолы); гетероароматические соединения, т. е. обладающие ароматичностью гетероциклические системы (например, пиридин, пиримидин, тиофен, фуран). К ароматическим соединениям относят также некоторые макроциклические аннулены (например, [18]аннулен), элементоорганические соединения (например, ферроцен), соединения тропилия и пр.
Свойства
Ароматические соединения – жидкости или твёрдые вещества. Для них характерно наличие т. н. магнитного кольцевого тока и резонанс в слабопольной («ароматической») части спектра ЯМР (6,5–8,0 м. д. для 1H и 110–170 м. д. для 13C). Ароматические соединения вступают в реакции электрофильного замещения (например, галогенирование, нитрование, сульфирование, алкилирование и ацилирование по Фриделю – Крафтсу). Введение электрофила E+ в молекулу ароматического соединения облегчается, и электрофил направляется преимущественно в орто- и пара-положения цикла при наличии в молекуле ароматического соединения заместителей, являющихся ориентантами 1-го рода (алкилы, арилы, атомы галогенов, группы OR, NR2, SR, где R – органический радикал), затрудняется и направляется преимущественно в мета-положение цикла заместителями – ориентантами 2-го рода (COR, COOR, CN, NO2, SO2R, SO3H). Электрофильное замещение протекает по механизму присоединения – отщепления через катионный σ-комплекс – интермедиат Уэланда (X – заместитель):
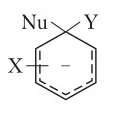
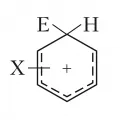 Катионный σ-комплекс (интермедиат Уэланда).Ароматические соединения вступают также в реакции нуклеофильного замещения при действии нуклеофилов Nu-, например R2N-, RO-, RS-, (RCO)2CH-, галогенид-анионов. При этом в молекуле ароматических соединений замещаются атомы галогенов, группы NO2, NR2, OR, SR, SO3H, реже – атомы водорода. Такие реакции часто протекают в жёстких условиях, например при повышенных температурах. Они облегчаются в присутствии соединений меди и особенно – при наличии в орто- или пара-положении к уходящей группе заместителя (ориентанта 2-го рода). Нуклеофильное замещение протекает главным образом по механизму присоединения – отщепления, через образование анионного σ-комплекса – интермедиат Майзенхаймера (Y – замещаемая группа):
Катионный σ-комплекс (интермедиат Уэланда).Ароматические соединения вступают также в реакции нуклеофильного замещения при действии нуклеофилов Nu-, например R2N-, RO-, RS-, (RCO)2CH-, галогенид-анионов. При этом в молекуле ароматических соединений замещаются атомы галогенов, группы NO2, NR2, OR, SR, SO3H, реже – атомы водорода. Такие реакции часто протекают в жёстких условиях, например при повышенных температурах. Они облегчаются в присутствии соединений меди и особенно – при наличии в орто- или пара-положении к уходящей группе заместителя (ориентанта 2-го рода). Нуклеофильное замещение протекает главным образом по механизму присоединения – отщепления, через образование анионного σ-комплекса – интермедиат Майзенхаймера (Y – замещаемая группа):
 Анионный σ-комплекс (интермедиат Майзенхаймера).Меньшее значение для ароматических соединений имеет гомолитическое замещение, например арилирование диазосоединениями и гидроксилирование с использованием реагента Фентона (H2O2 + CuSO4 + H2SO4). Ароматические соединения подвергаются металлированию (прямому замещению водорода или обмену галогена на металл при действии металлов или металлоорганических соединений). Реакции ароматических соединений по замещающим группам в целом подобны реакциям соответствующих алифатических соединений. Основные особенности – образование ароматическими аминами с HNO2 устойчивых диазосоединений, способных к азосочетанию и превращающихся при действии нуклеофилов в различные замещённые ароматические соединения. Из реакций присоединения для ароматических соединений наиболее важно каталитическое гидрирование – общий метод синтеза соединений ряда циклогексана. Ароматические соединения устойчивы к окислению. Алкилароматические соединения обычно окисляются по соседнему с ароматическим циклом атому углерода алкильного заместителя. Таким способом получают ароматические кислоты (например, терефталевую из n-ксилола), альдегиды (n-нитробензальдегид из n-нитротолуола), кетоны (ацетофенон из этилбензола) и спирты (трифенилкарбинол из трифенилметана).
Анионный σ-комплекс (интермедиат Майзенхаймера).Меньшее значение для ароматических соединений имеет гомолитическое замещение, например арилирование диазосоединениями и гидроксилирование с использованием реагента Фентона (H2O2 + CuSO4 + H2SO4). Ароматические соединения подвергаются металлированию (прямому замещению водорода или обмену галогена на металл при действии металлов или металлоорганических соединений). Реакции ароматических соединений по замещающим группам в целом подобны реакциям соответствующих алифатических соединений. Основные особенности – образование ароматическими аминами с HNO2 устойчивых диазосоединений, способных к азосочетанию и превращающихся при действии нуклеофилов в различные замещённые ароматические соединения. Из реакций присоединения для ароматических соединений наиболее важно каталитическое гидрирование – общий метод синтеза соединений ряда циклогексана. Ароматические соединения устойчивы к окислению. Алкилароматические соединения обычно окисляются по соседнему с ароматическим циклом атому углерода алкильного заместителя. Таким способом получают ароматические кислоты (например, терефталевую из n-ксилола), альдегиды (n-нитробензальдегид из n-нитротолуола), кетоны (ацетофенон из этилбензола) и спирты (трифенилкарбинол из трифенилметана).
Получение и применение
Ароматические соединения содержатся в нефти, однако в основном их получают в промышленности из продуктов коксования каменного угля и ароматизацией углеводородов; затем превращают в различные производные. Ароматические соединения – важные промежуточные и целевые продукты промышленного органического синтеза; их применяют в производстве красителей, лекарств, средств защиты растений, взрывчатых веществ, полимерных материалов. Ароматические углеводороды – компоненты высокооктановых бензинов.