АКТИВИ́РОВАННОГО КО́МПЛЕКСА ТЕО́РИЯ
-
Рубрика: Химия
-
-
Скопировать библиографическую ссылку:
АКТИВИ́РОВАННОГО КО́МПЛЕКСА ТЕО́РИЯ (теория абсолютных скоростей реакций, теория переходного состояния), метод статистич. расчёта скорости химич. реакции. Исходит из представления, согласно которому при непрерывном изменении относит. расположения атомов, входящих в реагирующую систему молекул, система проходит через конфигурацию, отвечающую максимуму потенциальной энергии взаимодействия, т. е. вершине потенциального барьера, разделяющего реагенты и продукты. А. к. т. была создана в 1930-х гг. Э. Вигнером, М. Поляни, М. Эвансом, Г. Эйрингом.
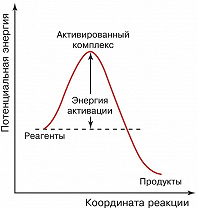
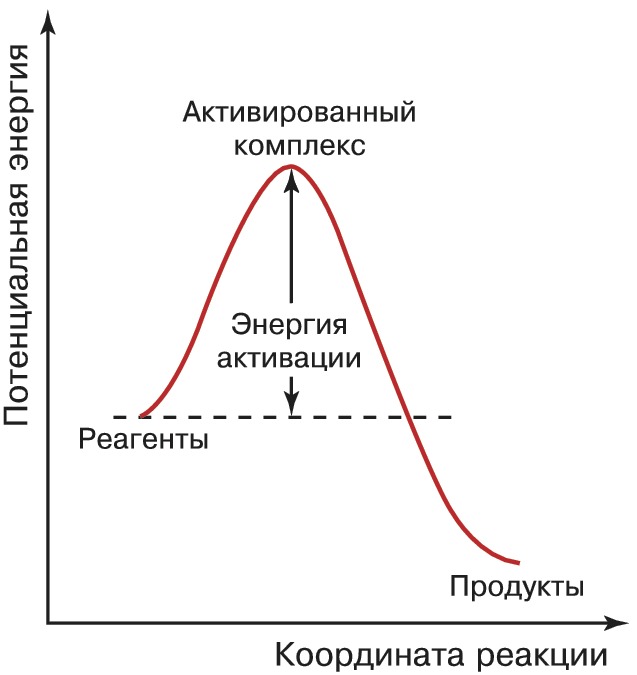
Потенциал взаимодействия между молекулами можно представить с помощью поверхности потенциальной энергии, и при непрерывном изменении конфигурации атомов от начального состояния (реагенты) до конечного (продукты) система преодолевает потенциальный барьер. Конфигурация атомов, отвечающая вершине потенциального барьера, называется активир. комплексом (переходным состоянием). Изменение потенциальной энергии в процессе типичного химич. превращения показано на рисунке. Координата реакции характеризует путь перехода от реагентов к продуктам химич. реакции через активир. комплекс, т. е. степень химич. перестройки во время протекания реакции. В общем случае она не сводится к изменению расстояния между какими-то конкретными атомами в реагирующих молекулах. Высота потенциального барьера, разделяющего реагенты и продукты, называется энергией активации и представляет собой миним. энергию, которой должны обладать реагенты для того, чтобы произошло химич. превращение.
Активир. комплекс считается короткоживущей молекулой; однако вследствие очень малого времени жизни (порядка 10–13 с) он не может рассматриваться как обычный компонент химически реагирующей системы и не может наблюдаться в обычных кинетич. экспериментах в отличие от активных промежуточных частиц (напр., радикалов). Важнейшее предположение А. к. т. состоит в том, что существует термодинамич. равновесие между активир. комплексами и реагентами (но не продуктами). При этом скорость образования продуктов (скорость химич. реакции) определяется равновесной концентрацией активир. комплексов и частотой их распада с образованием продуктов. Эти величины могут быть рассчитаны методами статистич. термодинамики, если известны структуры реагентов и активир. комплекса. Более того, во мн. случаях А. к. т. позволяет провести простые качеств. оценки, основывающиеся на имеющейся информации только о структуре реагентов. В этом состоит осн. достоинство А. к. т., позволяющей избежать решения очень сложных уравнений, описывающих классич. или квантовое движение системы атомов в поле сил химич. взаимодействия, и получить простую корреляцию между скоростью химич. реакции и свойствами реагентов на основе таких термодинамич. величин, как свободная энергия, энтропия и энтальпия. Поэтому А. к. т. остаётся осн. инструментом расчёта скоростей химич. реакций в термически равновесных системах с участием сложных молекул и интерпретации соответствующих эксперим. данных.
Как любая простая приближённая теория, А. к. т. имеет ограниченную область применимости. Она не может использоваться для расчёта констант скорости химич. реакций в термически неравновесных системах (напр., в рабочих средах газовых химич. лазеров). Что касается термически равновесных систем, то А. к. т. не может использоваться при очень низких темп-рах, где вследствие квантово-механич. эффекта туннелирования неприменимо представление о независящей от темп-ры энергии активации.